Содержание
Почвенный раствор — Развитие земельных и водных ресурсов
Почвенный раствор имеет огромное значение для развития растений, которые используют растворенные в нем элементы питания.
Состав, концентрация и реакция почвенного раствора весьма разнообразны и зависят от особенностей и интенсивности биохимических процессов в почве, состава гумуса, поглощенных катионов и содержания в ней легкорастворимых солей.
При разложении органических остатков происходит их минерализация с постепенным образованием водорастворимых органических и минеральных веществ. Кроме того, при развитии этих процессов образуется углекислый газ, который, растворяясь в воде, способствует растворению минеральных веществ почвы. Поглощенные катионы непрерывно взаимодействуют с катионами почвенного раствора, переходя в раствор.
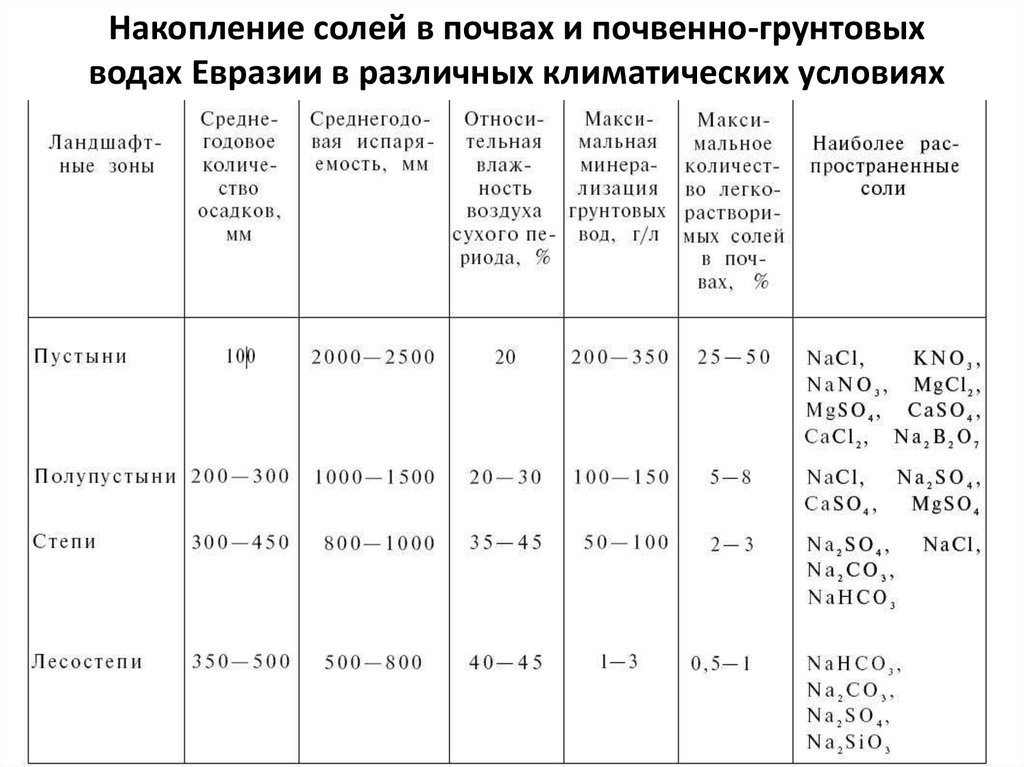
Содержание в почве легкорастворимых солей (хлоридов, сульфатов, карбонатов и некоторых фосфатов) также очень сильно влияет на состав и концентрацию почвенного раствора, поскольку соли растворяются в воде, поступающей в почву.
В состав почвенного раствора входят минеральные и органические вещества, находящиеся в молекулярной или коллоидной степени дисперсности и растворимые или пептизируемые в воде. Минеральная часть почвенного раствора представлена обычно бикарбонатами, сульфатами, нитратами и фосфатами, растворимыми в воде. В некоторых почвах есть также хлориды и сода. В очень незначительных количествах раствор может содержать соли кремниевой кислоты и полуторных окислов.
В состав органической части почвенного раствора входят водорастворимые гуминовые кислоты и их соли и незначительное количество водорастворимых промежуточных продуктов разложения органических остатков — аминокислоты, органические кислоты, сахара и т. д.
По концентрации почвенного раствора все почвы делятся на незасоленные и засоленные.
В незасоленных почвах концентрация почвенного раствора невелика и не превышает одного или нескольких граммов на 1 л раствора. Минеральная часть раствора представлена в основном бикарбонатами, а также небольшим количеством сульфатов и нитратов. Осмотическое давление почвенного раствора в этом случае ниже осмотического давления клеточного сока растений и не превышает 1—3 атмосфер. Элементы питания, находящиеся в почвенном растворе, доступны растениям.
Осмотическое давление почвенного раствора в этом случае ниже осмотического давления клеточного сока растений и не превышает 1—3 атмосфер. Элементы питания, находящиеся в почвенном растворе, доступны растениям.
В засоленных почвах концентрация почвенного раствора очень высока, часто достигает нескольких десятков и сотен граммов на 1 л раствора. Минеральная часть представлена в основном хлоридами, содой, сульфатами натрия, кальция и магния. Осмотическое давление почвенного раствора при высокой концентрации солей поднимается до 10—20 и более атмосфер, и растения не могут использовать минеральные вещества из такого раствора. Кроме того, сода и хлористый натрий вредны для растений.
Часть почвенного раствора входит в состав капиллярной и гравитационной влаги и вполне доступна растениям, другая часть — в состав прочносвязанных форм влаги и растением не используется.
Реакция почвенного раствора определяется концентрацией в нем водородных и гидроксильных ионов и зависит от содержания в растворе кислот, их кислых и щелочных солей.
В почвах, содержащих в составе обменных катионов, кроме щелочно-земельных, ионы водорода и алюминия (выщелоченные и оподзоленные черноземы, серые лесные почвы, дерново-подзолистые почвы), реакция почвенного раствора определяется одновременным присутствием гидрокарбоната кальция, свободной углекислоты, органических кислот и их солей и изменяется в пределах рН от 7 до 5.
Сильнокислая и сильнощелочная реакция почвенного раствора крайне неблагоприятна для растений, а иногда и губительна. Благоприятной является слабокислая или слабощелочная реакция в пределах рН 6—7,5.
Наиболее распространенным методом определения концентрации и состава почвенного раствора является метод водной вытяжки с последующим анализом фильтрата. Более правильную картину о концентрации и составе почвенного раствора дают прямые методы вытеснения и анализа почвенных растворов, разработанные в последнее время. Необходимо отметить, что состав, концентрация и реакция почвенного раствора очень изменяются даже в течение вегетационного периода. Во время интенсивного развития растений и потребления ими элементов питания, а также при выпадении обильных атмосферных осадков концентрация раствора понижается. В засушливое время года, а также в периоды интенсивного разложения органических остатков она повышается.
Во время интенсивного развития растений и потребления ими элементов питания, а также при выпадении обильных атмосферных осадков концентрация раствора понижается. В засушливое время года, а также в периоды интенсивного разложения органических остатков она повышается.
Состав почвенного раствора изменяют внесением удобрений, агротехникой и мелиорацией. Поэтому для правильного регулирования почвенного раствора необходимо хорошо знать почву, чтобы установить причины, от которых зависит состав почвенного раствора, и разработать мероприятия по его улучшению.
Почвенный раствор
Почвенный раствор – жидкая фаза почвы — служит источником питательных веществ для растений. Их рост и развитие зависят от его состава и концентрация. Изучением почвенного раствора занимались Гедройц, Шмук. Почвенный раствор имеет большое значение в перемещении продуктов почвообразования по профилю, участвует в динамике почвенных процессов, определяет реакцию среды в почве и буферные свойства почвы. Изучением почвенного раствора занимались Гедройц, Шмук. Источником почвенного раствора являются атмосферные осадки, грунтовые воды. Этот раствор включает все формы капиллярной, рыхло — и прочносвязанной влаги, поэтому количество выделяющегося почвенного раствора зависят от степени увлажнения почвы и ее водоудерживающей способности.
Изучением почвенного раствора занимались Гедройц, Шмук. Источником почвенного раствора являются атмосферные осадки, грунтовые воды. Этот раствор включает все формы капиллярной, рыхло — и прочносвязанной влаги, поэтому количество выделяющегося почвенного раствора зависят от степени увлажнения почвы и ее водоудерживающей способности.
Почвенный раствор — подвижная система, состав которой меняется по сезонам года, что связано с сезонными изменениями тепла и влаги, поступлением органических остатков и процессов их трансформации. В почвенный раствор входят органические, минеральные и органоминеральные соединения в состоянии истинных и коллоидных растворов. Органическими: водорастворимыми солями органических кислот, фульвокислот, аминокислотами, сахарами и др. Минеральными: анионы НСОз, NОз, НзРО4; катионы н+, са2+, мg2+, к+, n3+, al3+ , ре, ре+, микроэлементы. Концентрация почвенного раствора около 0,1 — 0,3 г/л и редко достигает 1 г/л. Наиболее низкая концентрация в растворах подзолистых и болотных, в черноземах и солонцах достигает 1—3 г/л, а в солончаках доходит до 300 — 400 г/л. Между общей концентрацией солей в растворах и соотношением отдельных ионов наблюдается такая зависимость: в слабо концентрированных растворах преобладают двууглекислые соли кальция, а по мере повышения концентрации происходит накопление сернокислых и хлористых солей магния н натрия. Состав солей, соотношение между катионами и анионами определяют реакцию почвенного раствора (актуальную кислотность или актуальную щелочность и осмотическое давление, от которого зависит поступление воды в растение. Если оно равно осмотическому давлению клеточного сока растений или выше его, то поступление воды в него прекращается. Сосущая сила корней большинства растений не превышает 100 — 120 мпа, при низких концентрациях почвенного раствора осмотическое давление составляет не больше 10 мпа. В сильно засоленных почвах оно мажет возрастать до 150 — 260 мпа, больше при хлоридном, меньше при сульфатном засолении. Такие почвы нуждаются в химической мелиорации и промывке от солей (почвы тяжелого гранулометрического состава).
Между общей концентрацией солей в растворах и соотношением отдельных ионов наблюдается такая зависимость: в слабо концентрированных растворах преобладают двууглекислые соли кальция, а по мере повышения концентрации происходит накопление сернокислых и хлористых солей магния н натрия. Состав солей, соотношение между катионами и анионами определяют реакцию почвенного раствора (актуальную кислотность или актуальную щелочность и осмотическое давление, от которого зависит поступление воды в растение. Если оно равно осмотическому давлению клеточного сока растений или выше его, то поступление воды в него прекращается. Сосущая сила корней большинства растений не превышает 100 — 120 мпа, при низких концентрациях почвенного раствора осмотическое давление составляет не больше 10 мпа. В сильно засоленных почвах оно мажет возрастать до 150 — 260 мпа, больше при хлоридном, меньше при сульфатном засолении. Такие почвы нуждаются в химической мелиорации и промывке от солей (почвы тяжелого гранулометрического состава). Большое значение в регулировании почвенного раствора имеют орошение (разбавить концентрированные растворы) и осушение (понизить концентрацию оксидных соединений железа и др токсичных соединений). Оптимальная концентрация солей в почвенном растворе — 0,02 %.
Большое значение в регулировании почвенного раствора имеют орошение (разбавить концентрированные растворы) и осушение (понизить концентрацию оксидных соединений железа и др токсичных соединений). Оптимальная концентрация солей в почвенном растворе — 0,02 %.
| < Предыдущая | Следующая > |
|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Дом | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
pH почвы является полезным индикатором относительной кислотности или щелочности почвы. Шкала рН колеблется от 0 до 14, и почве присваивается значение по шкале рН для описания кислотности или щелочности. Поскольку pH 7 находится в середине шкалы, значения pH, равные 7, считаются нейтральными. Однако значения pH ниже 7 являются кислыми, а значения pH выше 7 — щелочными. По определению, pH почвы – это измерение концентрации ионов водорода в почвенной воде. Напомним, что ион водорода представляет собой кислотный катион . Таблица 1. рН некоторых обычных предметов.
Источник: Хюэ Н. Рисунок 3 . Значения pH обычных веществ. pH почвы является важным свойством почвы, поскольку он влияет на химические, биологические и физические процессы в почве. Таким образом, pH часто считается «основной переменной» почвы. Его важность в управлении питательными веществами нельзя недооценивать. Чтобы понять значение pH, его эффекты перечислены ниже: Влияние pH почвы:Доступность питательных веществ
Рисунок 4 . Влияние pH почвы на доступность основных элементов растений. Утолщенные линии указывают на большую доступность питательных веществ, тогда как узкие линии указывают на снижение доступности. Биологическая активность и процессы
Физически
Происхождение кислотности Существует множество источников кислотности почвы. Ниже приведен список причин, наиболее распространенных на Гавайях:
Бассейны кислотности почвы Существует три основных пула или источника кислотности: активный, обменный или остаточный.
Буферная емкостьКоличество алюминия и водорода в каждом из 3 пулов кислотности постоянно не фиксируется. Вместо этого относительное количество алюминия и водорода может меняться по мере того, как алюминий и водород перемещаются из пула в пул. Таким образом, говорят, что почва обладает буферной емкостью . Буферная способность – это способность почвы сопротивляться изменениям. В случае кислотности это способность почвы сопротивляться изменению рН. Таким образом, алюминий и водород одного пула будут пополнять алюминий и водород другого пула по мере удаления этих кислотных катионов. Например, по мере удаления алюминия и водорода из почвенного раствора кислотные катионы ЦИК пополняют почвенный раствор. Точно так же минералы, содержащие алюминий и водород, растворяются и высвобождают эти катионы по мере их удаления из обменного пула. Список реакций буферизации:
Каждая почва обладает уникальной буферной способностью. Эмпирическое правило
Напомним, что 90% почв Гавайев попадают в эту категорию. В результате большинство почв Гавайев в значительной степени смягчают кислотность почвы. Это имеет большое значение для управление питательными веществами , поскольку буферная способность определяет количество ресурсов, таких как известь, которые необходимо добавить для корректировки кислотности почвы. Почвы с высокой буферной способностью требуют большего количества ресурсов для известкования для повышения pH до целевого значения, чем почвы с низкой буферной способностью. Проблемы, связанные с кислотностью в округе Мауи Основными проблемами, связанными с кислотностью почвы на Гавайях, являются токсичность алюминия и марганца. Токсичность алюминияТоксичность алюминия может проявляться в почвах, содержащих большое количество алюминийсодержащих минералов. В таких почвах алюминий может растворяться в почвенном растворе, когда рН почвы падает ниже 5,4. Напротив, растворимость алюминия резко снижается, когда рН почвы превышает 5,4. В результате надлежащее управление pH почвы может предотвратить проблемы, связанные с токсичностью алюминия.
Условия, вызывающие токсичность алюминияТоксичность алюминия легко возникает в кислых условиях, особенно когда значения pH равны или меньше 5,4. В кислых почвах тропиков токсичность алюминия может стать серьезной проблемой и ограничить урожайность. Управление рН почвы является ключевым фактором в предотвращении токсичности алюминия. Отравление алюминием может быть уменьшено путем известкования полей. Токсичность марганца Токсичность марганца может стать проблемой в почвах с марганецсодержащими минералами. Когда эти минералы растворяются, ионы марганца выделяются в почвенный раствор. Симптомы токсичности марганца включают пожелтение листьев (хлороз) старых листьев, которые темнеют и превращаются в маленькие коричневые пятна. Хотя устойчивость культур к токсичности марганца варьируется, большинство культур чувствительны к высоким уровням марганца. Например, токсичность марганца приведет к синдрому «внезапного падения» арбуза, при котором растения внезапно увядают и умирают. Сообщалось о случаях «внезапного крушения» на Оаху. Условия, вызывающие токсичность марганца Токсичность марганца может развиться в почвах, содержащих минералы марганца. Особенно восприимчивы влажные органические почвы в кислых условиях. Как и при отравлении алюминием, очень важно регулировать pH. Когда рН почвы падает ниже 5,2, минералы марганца становятся хорошо растворимыми и, возможно, токсичными. Фермеры могут снизить токсичность марганца путем известкования и аэрации полей. Таблица 2. Влияние pH почвы на алюминий и марганец на отдельных полях сахарного тростника в Оаху. Источник: Hue, N.V., J.A. Сильва, Г. Уэхара, Р.Т. Хамасаки, Р. Учида и П. Банн. 1998. Управление токсичностью марганца в Для отличного обсуждения токсичности марганца щелкните следующую ссылку. В этой публикации обсуждается влияние токсичности марганца на урожай и приводятся рекомендации по управлению, а также изображения симптомов токсичности марганца: Управление кислотностью почвыЗемлеустроители могут управлять кислотностью почвы, повышая pH до желаемого значения несколькими способами:
ИзвесткованиеЕсли вы принимаете решение внести известь в почву, сколько извести следует вносить? Как и другие свойства почвы, потребность в извести будет варьироваться в зависимости от почвы. Существуют четыре рекомендации , которые помогают нам определить потребность в извести: желаемое изменение pH, буферная способность конкретной почвы, тип известкового материала и крупность или текстура известкового материала.
Эквивалент карбоната кальция известковых материаловЭквивалент карбоната кальция (CCE) является важным показателем при определении того, сколько извести следует вносить в почву.
Таблица 3. Различные известковые материалы и их относительная нейтрализующая способность Источник: Учида Р.С. и Н.В. Хью. Кислотность почвы и известкование. стр.101-111. В: Сильва, Дж.А. и Учида, Р.С. (ред.) Управление питательными веществами растений в почвах Гавайев: подходы к тропическому и субтропическому сельскому хозяйству. Колледж тропического сельского хозяйства и человеческих ресурсов Гавайского университета в Маноа, Гонолулу. Нейтрализующий сменный алюминийПрямым преимуществом известкования почвы является снижение насыщения ее алюминием. Большинство растений страдают, когда насыщение алюминием превышает 15%. Вы можете сначала определить насыщение алюминием путем тестирования почвы, а затем определить, сколько извести требуется для нейтрализации обменного алюминия. Это особенно важно в тропиках, где насыщение алюминием может стать высоким. Кривые известкованияЛегко читаемые и интерпретируемые кривые известкования являются очень полезными инструментами для определения эквивалента карбоната кальция, который необходимо добавить в конкретную почву для достижения целевого уровня pH. Кривые известкования можно определить экспериментально и откалибровать для конкретных почв. CTAHR опубликовала кривые известкования для отдельных почв Гавайев, которые доступны в Интернете. Чтобы просмотреть кривые известкования для выбранных почв Гавайских островов, щелкните следующие две ссылки ниже: Внесение и передефекация После равномерного внесения на поверхность почвы известь необходимо тщательно взрыхлить для оптимальной нейтрализации кислотности почвы. Поскольку известковый материал может реагировать только на той глубине, на которую он внесен, может потребоваться безотвальная обработка почвы для снижения кислотности почвы. Известкование почв, засаженных многолетними культурами, также можно проводить поверхностным внесением с минимальной обработкой почвы или без нее. Орошение и дожди медленно вымывают известь, которая относительно нерастворима, с поверхности в профиль почвы, где она может реагировать, нейтрализуя кислотность почвы. Использование надлежащего состава удобрений является важным способом управления подкислением почвы, особенно в системах с многолетними культурами, где известкование вносится труднее, чем в однолетних или краткосрочных системах. Несмотря на многочисленные преимущества извести, чрезмерное известкование почвы имеет негативные последствия. Важно тщательно продумать, сколько нужно добавить извести. Если pH почвы слишком высок, это может вызвать дефицит питательных веществ (например, дефицит фосфора и питательных микроэлементов), а также привести к токсичности молибдена. ГипсГипс – это кондиционер почвы, который можно использовать для устранения проблем с алюминием в подповерхностных слоях почвы. Однако важно различать известь и гипс. Хотя оба являются источниками кальция, известь повышает pH почвы, а гипс — нет. Ящик для инструментов Для облегчения расчета известкования и внесения удобрений мы предлагаем простые в использовании калькуляторы. Эти калькуляторы позволяют мгновенно определить необходимое количество удобрений или извести, исходя из конкретных размеров земли и целевого уровня питательных веществ. Кроме того, поскольку эти калькуляторы были созданы в формате Excel, вы можете удобно сохранять свои расчеты в архивах записей. | |||||||||||||||||||||||||

 2.
2.

 1
1 Это характерно для почв. А также почвы
Это характерно для почв. А также почвы

 Чем больше концентрация ионов водорода в водном растворе почвы, тем ниже рН. В свою очередь, чем ниже значение pH, тем выше будет кислотность почвы. Концентрация ионов водорода в почвенном растворе прямо пропорциональна и находится в равновесии с ионами водорода, удерживаемыми катионообменным комплексом почвы. Таким образом, ионы водорода, удерживаемые частицами глины, восполняют или буферизуют ионы водорода в почвенной воде.
Чем больше концентрация ионов водорода в водном растворе почвы, тем ниже рН. В свою очередь, чем ниже значение pH, тем выше будет кислотность почвы. Концентрация ионов водорода в почвенном растворе прямо пропорциональна и находится в равновесии с ионами водорода, удерживаемыми катионообменным комплексом почвы. Таким образом, ионы водорода, удерживаемые частицами глины, восполняют или буферизуют ионы водорода в почвенной воде.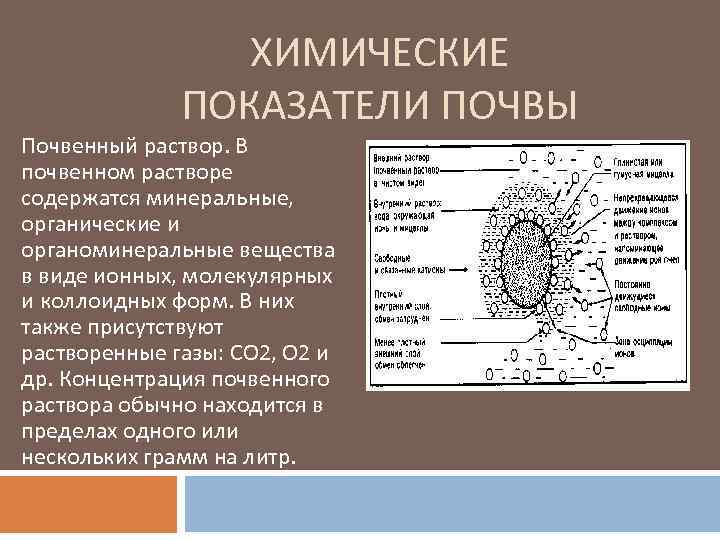 В. и Икава И. Кислые почвы на Гавайях: проблемы и управление. CTAHR.
В. и Икава И. Кислые почвы на Гавайях: проблемы и управление. CTAHR. 


 Как правило, глинистые почвы с мелкой текстурой обладают большей буферной способностью, чем почвы с грубой текстурой.
Как правило, глинистые почвы с мелкой текстурой обладают большей буферной способностью, чем почвы с грубой текстурой. Обе токсичности, если их не предотвратить, могут нанести серьезный ущерб урожаю и урожайности.
Обе токсичности, если их не предотвратить, могут нанести серьезный ущерб урожаю и урожайности.
 Хотя марганец является важным питательным веществом для растений, чрезмерное количество марганца может быть вредным для роста растений.
Хотя марганец является важным питательным веществом для растений, чрезмерное количество марганца может быть вредным для роста растений. Аэрация может быть достигнута за счет меньшего орошения или отвода воды с полей.
Аэрация может быть достигнута за счет меньшего орошения или отвода воды с полей. Однако этот эффект хорош только на то время, на которое грунт затапливается. Затопленные или рисовые минеральные почвы являются «самоизвестковыми». Когда они затапливаются и становятся анаэробными (недостаток кислорода в почвенной атмосфере) на определенный период времени, рН повышается до нейтрального уровня, даже если изначально рН почвы был кислым. Если почва впоследствии осушается и становится более аэробной (больше кислорода в почвенной атмосфере), pH возвращается к кислому состоянию.
Однако этот эффект хорош только на то время, на которое грунт затапливается. Затопленные или рисовые минеральные почвы являются «самоизвестковыми». Когда они затапливаются и становятся анаэробными (недостаток кислорода в почвенной атмосфере) на определенный период времени, рН повышается до нейтрального уровня, даже если изначально рН почвы был кислым. Если почва впоследствии осушается и становится более аэробной (больше кислорода в почвенной атмосфере), pH возвращается к кислому состоянию.
 Известковые материалы – это основания, которые реагируют с ионами водорода в почвенном растворе с образованием воды?
Известковые материалы – это основания, которые реагируют с ионами водорода в почвенном растворе с образованием воды? Чтобы избежать проблем с токсичностью алюминия и марганца, почву следует известковать, если рН ниже 5,4.
Чтобы избежать проблем с токсичностью алюминия и марганца, почву следует известковать, если рН ниже 5,4.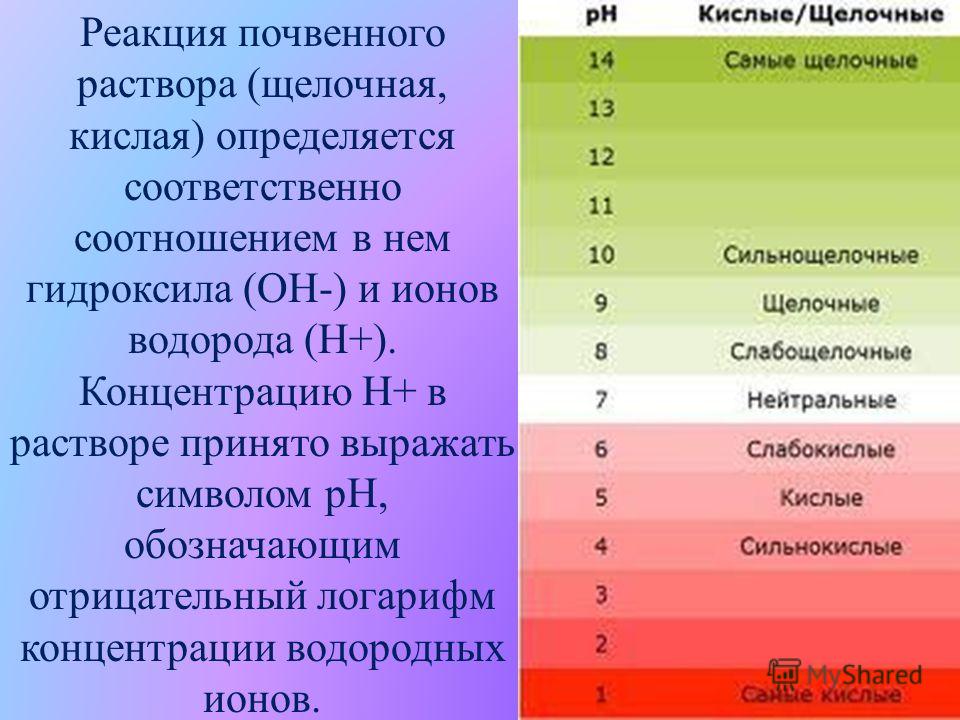 Однако нанесение очень тонкой извести может быть затруднено, особенно в ветреную погоду.
Однако нанесение очень тонкой извести может быть затруднено, особенно в ветреную погоду.
 ctahr.hawaii.edu/oc/freepubs/pdf/AS-1.pdf
ctahr.hawaii.edu/oc/freepubs/pdf/AS-1.pdf