Содержание
Аммиак подорожал до исторического максимума из-за высоких цен на газ
Пиковые цены на аммиак являются следствием сразу нескольких причин / Тимур Батыршин / РИА Новости
Цены на аммиак на мировом рынке обновили исторические максимумы на фоне дорогого газа. К концу ноября, по данным Argus, они преодолели в Европе отметку в $1000 за 1 т. Стоимость продукта также приблизилась к $1000 в портах Тампа-Бэй и Новый Орлеан (США), достигнув максимума за 33 года.
Цена на аммиак в Европе на условиях поставки CFR 25 ноября составляла $998,5 за 1 т, в США – $990 за 1 т, следует из последних данных Refinitiv. Предыдущий максимум цен на аммиак в Европе был достигнут 18 ноября ($895,5 за 1 т), в США – 28 октября ($825 за 1 т). Ранее максимальный уровень цен фиксировался в 2012 г. – $730 и $720 за 1 т соответственно.
Аммиак дорожает вслед за газом – основным сырьем для его производства. Еще в июне 2021 г. цены на газ на европейском спотовом рынке держались на уровне $330–430 за 1000 куб. м. Но с середины сентября цены в Европе не опускаются ниже $700 за 1000 куб. м, в Азии газ еще дороже. На 30 ноября январские фьючерсы на газ на крупнейшем европейском хабе TTF в Нидерландах торговались по $1132 за 1000 куб. м, в Азии на 29 ноября, по данным Platts, цена достигала $1280 за 1000 куб. м
м. Но с середины сентября цены в Европе не опускаются ниже $700 за 1000 куб. м, в Азии газ еще дороже. На 30 ноября январские фьючерсы на газ на крупнейшем европейском хабе TTF в Нидерландах торговались по $1132 за 1000 куб. м, в Азии на 29 ноября, по данным Platts, цена достигала $1280 за 1000 куб. м
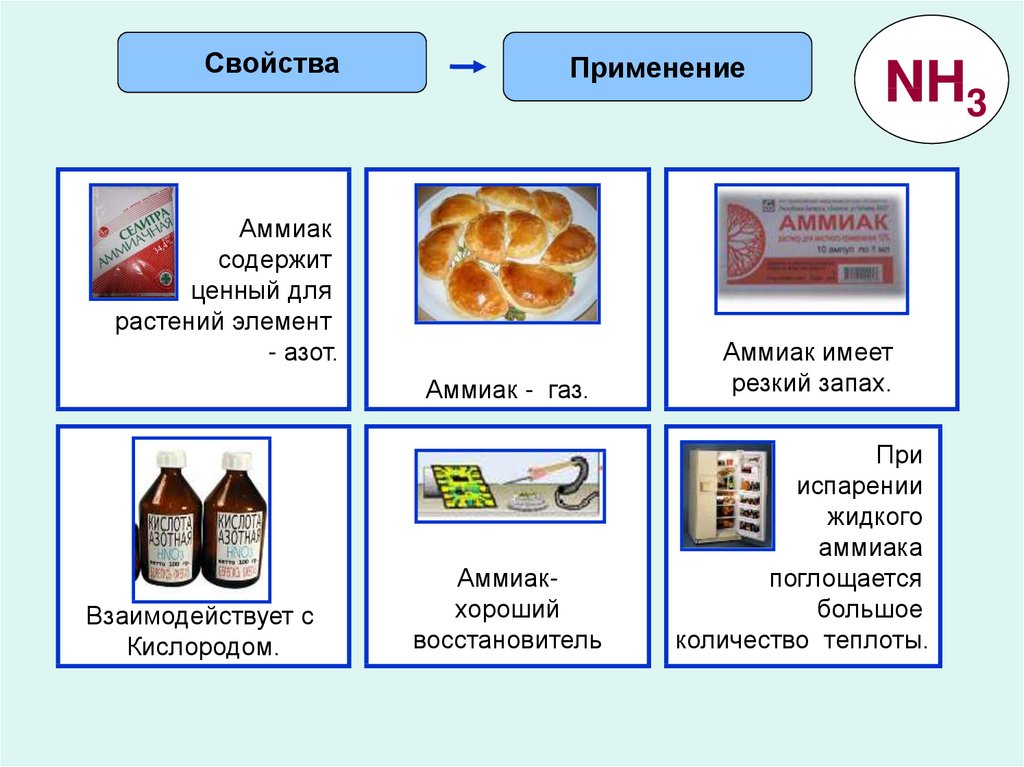
Аммиак преимущественно используется как сырье для производства азотных и азотсодержащих удобрений, в частности аммиачной селитры. Он также используется в химии, медицине и при производстве взрывчатых веществ.
По оценкам Argus, при стоимости газа выше $20 за 1 MMBTU (миллион британских тепловых единиц), или более $700 за 1000 куб. м, расходы только на газ для получения аммиака приближаются к $800 за 1 т, а полная себестоимость аммиака еще выше.
При такой стоимости газа и аммиака, используемого в качестве сырья для азотных удобрений, их выпуск становится нерентабельным («Ведомости» ранее писали об этом).
Как квотируют экспорт удобрений
Экспортные квоты введены правительством для гарантирования поставок удобрений российскому агропрому и сдерживания цен на удобрения с 1 декабря 2021 г.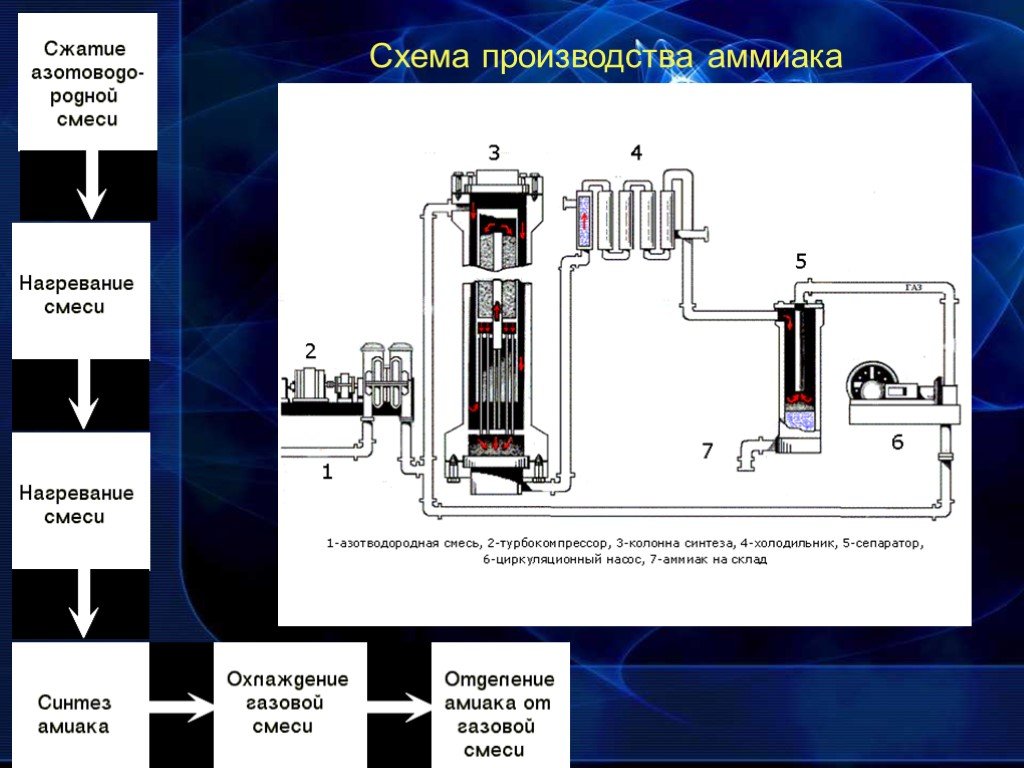 до конца мая 2022 г. Химики смогут в этот период поставить на экспорт за пределы ЕАЭС не более 5,9 млн т азотных и не более 5,35 млн т сложных удобрений. Квоты распределены по производителям. По азотным удобрениям основные объемы получили входящий в «Фосагро» «Апатит» (759 600 т), НАК «Азот» (697 700 т), «Уралхим» (551 500 т), «Акрон» (465 100 т) и «Тольяттиазот» (428 000 т). Крупные квоты по сложным удобрениям достались «Апатиту» (2,7 млн т), «Уралхиму» (572 600 т) и «Акрону» (693 000 т).
до конца мая 2022 г. Химики смогут в этот период поставить на экспорт за пределы ЕАЭС не более 5,9 млн т азотных и не более 5,35 млн т сложных удобрений. Квоты распределены по производителям. По азотным удобрениям основные объемы получили входящий в «Фосагро» «Апатит» (759 600 т), НАК «Азот» (697 700 т), «Уралхим» (551 500 т), «Акрон» (465 100 т) и «Тольяттиазот» (428 000 т). Крупные квоты по сложным удобрениям достались «Апатиту» (2,7 млн т), «Уралхиму» (572 600 т) и «Акрону» (693 000 т).
В сентябре 2021 г. крупные компании, работающие в Европе, начали останавливать производство азотных удобрений из-за высоких цен на газ. В частности, о приостановке производства или сокращении выпуска объявляли американская CF Industries (заводы компании в Британии), норвежская Yara, испанская Fertiberia, нидерландская OCI, украинская Ostchem. Аналитики Fitch Ratings тогда утверждали, что производители удобрений в ЕС будут стремиться повысить цены на продукцию, чтобы переложить дополнительные расходы, связанные с ростом цен на газ, на потребителей.
Кроме того, объемы поставок российской продукции по аммиакопроводу Тольятти – Одесса (мощность до 2,5 млн т в год) уменьшились, из-за того что Украина снизила скорость прокачки на фоне подорожания необходимого для работы трубопровода топлива, отмечает Argus.
По данным Refinitiv, цены на азотные удобрения также уже достигли исторических максимумов: карбамид на условиях поставки FOB Черное море в середине ноября торговался по $868 за 1 т, карбамидно-аммиачная смесь – по $633 за 1 т.
Газ все еще дорог на фоне ажиотажного спроса в Азии и задержек с сертификацией газопровода «Северный поток – 2» в Европе, говорит управляющий директор рейтинговой службы НРА Сергей Гришунин. Консультант Vygon Consulting Артем Лебедской-Тамбиев добавляет, что цена газа, основного сырья для выпуска азотных удобрений, составляет до 80% в себестоимости конечного продукта.
Пиковые цены на аммиак, по словам начальника управления аналитики по рынку ценных бумаг Альфа-банка Бориса Красноженова, являются следствием сразу нескольких причин. Во-первых, высокие цены на газ, во-вторых, сокращение предложения аммиака в ЕС из-за закрытия ряда производств. И в-третьих, по его мнению, дополнительные риски в ЕС создает введение квот на экспорт российских азотных удобрений.
Во-первых, высокие цены на газ, во-вторых, сокращение предложения аммиака в ЕС из-за закрытия ряда производств. И в-третьих, по его мнению, дополнительные риски в ЕС создает введение квот на экспорт российских азотных удобрений.
По словам Гришунина, аммиак не подешевеет, пока не пойдут вниз цены на газ, а это, вероятнее всего, произойдет во втором полугодии 2022 г. По оценке Лебедского-Тамбиева, значительного снижения цен на газ не стоит ожидать до окончания отопительного сезона в ЕС, т. е. до конца I квартала 2022 г. В свою очередь, Красноженов добавляет, что, если продолжится рост спроса на сельхозпродукцию, в том числе зерновые, а цены на газ значительно не упадут, текущий уровень цен азотных удобрений может сохраниться и в 2022 г. с риском дальнейшего повышения. Снижение цен может произойти в случае замедления производственной инфляции и более быстрого ужесточения политики ФРС США.
От скачка цен на аммиак прежде всего страдает сельское хозяйство, поскольку вслед за ним дорожают и удобрения, говорит Гришунин. По разным оценкам аналитиков, для выпуска удобрений используется от 40 до 85% аммиака в мире. По оценке Красноженова, мировой рынок аммиака оценивается примерно в $65 млрд.
По разным оценкам аналитиков, для выпуска удобрений используется от 40 до 85% аммиака в мире. По оценке Красноженова, мировой рынок аммиака оценивается примерно в $65 млрд.
По данным Vygon Consulting, ключевыми производителями аммиака в России являются «Еврохим», «Тольяттиазот» и «Уралхим» (21, 16 и 15% от производства аммиака соответственно). «Еврохим» и «Уралхим» большую часть аммиака перерабатывают самостоятельно. «Тольяттиазот» экспортирует порядка 2 млн т аммиака в год, на долю компании приходится более 10% мировых поставок, говорит Лебедской-Тамбиев. Аммиак в России также производят «Акрон», «Фосагро» и «Куйбышевазот», а кроме того, предприятия «Азот» (Кемерово) и «Минудобрения» (Россошь). Красноженов оценивает суммарный объем экспорта аммиака из России в 2021 г. в 4–4,4 млн т.
Заработать на высоких ценах смогут все российские экспортеры аммиака и азотных удобрений, уверены эксперты. С учетом регулируемых цен на газ в России производители аммиака сейчас находятся в очень выгодном положении, указывает Лебедской-Тамбиев.
Но серьезно нарастить экспорт российским компаниям будет сложно из-за ограниченных мощностей российских портов, замечает Красноженов. Гришунин добавляет, что ограничение экспорта азотных удобрений с декабря по решению правительства не позволит вывезти около 1,2 млн т азотных удобрений и около 200 000 т комплексных.
В «Тольяттиазоте» «Ведомостям» сообщили, что объем прокачки аммиака по трубопроводу Тольятти – Одесса снижен по решению компании «Укрхимтрансаммиак» (управляет украинским участком трубы), не уточнив планы по экспорту продукта. В других компаниях не ответили на запросы на момент публикации.
В подготовке статьи участвовала Елена Филимонова
Новости СМИ2
Отвлекает реклама? С подпиской
вы не увидите её на сайте
Как получают аммиак в промышленности и где используется, какой класс опасности. Читайте в блоге «ТАНТАЛ-Д»
Автор статьи
Лебедев Юрий Агафонович
Дата публикации:
01.02.2022
Дата обновления:
18. 01.2023
01.2023
Заместитель директора
Работает в отрасли
c 1999 г.
Вещество, распространенное в большей мере в форме резко пахнущего бесцветного газа, и представляющее собой нитрид водорода, широко известно как аммиак. Сферы его применения разнообразны. Химическое соединение используют для изготовления удобрений с азотом, соды, взрывчатых веществ, полимерных составов и иных промышленных продуктов. В жидкой форме вещество применяют как растворитель, в твердой оно представляет собой кубические кристаллы. В его составе один атом азота и три — водорода.
Синтетический аммиак незаменим в производстве азотных удобрений.
Вячеслав Жвирблис
Содержание статьи
- Производство
- К какому классу веществ относится аммиак
- Области применения аммиака
- в производстве
- в холодильных установках
- в медицине
- Какая формула у аммиака
- Свойства NH₃
- Воздействие аммиака на физиологию
- Некоторые факты об аммиаке
Длительное воздействие аммиачного газа представляет опасность для человека, потому что вызывает отек легких и угнетение нервной системы. Опасность повышает отсутствие запаха у вещества.
Опасность повышает отсутствие запаха у вещества.
Из этой статьи вы подробнее узнаете о том, где используют аммиак, как его получают в промышленности, как выглядит химическая формула, где используется в медицине, в производстве, к какому классу опасности относится аммиак.
Производство
Ежегодно в мире химические предприятия выпускают порядка 180 миллионов тонн аммиака. Как образуется аммиак? В результате непосредственного соединения водорода и азота, при протекании химической реакции с выделением тепла:
N2 + 3NH3 + 91,84 кДж
Наибольший выход аммиака 30% достигается при температуре 500°C и давлении в 350 атмосфер, притом для протекания реакции используют катализатор — пористое железо с оксидом калия. Из чего делают аммиак на производстве, на заводе? Его синтезируют из азота и водорода при высокой температуре. К молекуле двухатомного азота добавляют три двухатомные молекулы водорода.
К какому классу веществ относится аммиак
Согласно классификации ГОСТ 12.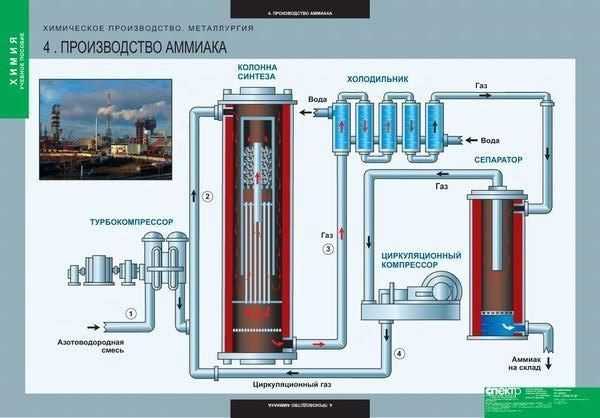 1.007, данное вещество относится к малоопасным веществам и принадлежит к четвертому классу опасности.
1.007, данное вещество относится к малоопасным веществам и принадлежит к четвертому классу опасности.
Оно хорошо растворяется в воде. В жидкой форме оно почти не проводит ток и сильно преломляет свет. Его запах ощутим, если концентрация аммиачных паров достигает 37 мг/м³.
Области применения аммиака
В производстве
Из аммиака изготавливают азотсодержащие удобрения, полимеры, соду. Его используют как противоморозный компонент строительной смеси, а также для придания аромата цветам без запаха или для изменения их окраски.
В холодильных установках
Где еще используется аммиак? В системах охлаждения. Он служит хладагентом. В том числе с его помощью охлаждают каналы энергоснабжения МКС.
В медицине
Используется для нанесения на поверхность кожи, ингаляций и приема внутрь, для приведения в сознание человека при обмороке. Аммиак применяют при укусах насекомых, невралгии, для повышения давления, для очищения поверхностей, в том числе рук хирурга.
Какая формула у аммиака
Формула вещества — NH3. Его молекула представляет собой пирамиду, где в основании атомы водорода, а наверху — атом азота.
Свойства NH₃
Аммиак — комплексообразователь. Его раствор, известный как нашатырь, обладает слабощелочной реакцией. При взаимодействии с кислотами, производит соли аммония. Вещество также слабая кислота. Взаимодействуя с металлами, оно образует соли.
Аммиачные растворы амидов — проводники тока. Нагреваясь, аммиак разлагается. Вещество горит в атмосфере кислорода, продукты горения — вода и азот. Хлор и йод под воздействием аммиака формируют взрывчатые вещества. При температуре 1000°C NH3 реагирует с углем, в результате образуется синильная кислота. Аммиак реагирует и с метаном, продукт реакции тот же.
Воздействие аммиака на физиологию
Для живого организма аммиак опасен своей токсичностью. Он действует удушающе, оказывает нейротропный эффект. При ингаляционном воздействии может провоцировать отек легких, угнетать нервную систему. У вещества местное и резорбтивное действие.
У вещества местное и резорбтивное действие.
Воздействие паров NH3 приводит к раздражению слизистой и кожи. Такое раздражение воспринимается рецепторами как резкий запах, проявляется слезотечением, потерей зрения вследствие химического ожога, кашлем, зудом. Если сжиженный аммиак касается кожи, ее обжигает, на ней могут появиться пузыри. Испаряясь, он поглощает тепло, а касаясь кожного покрова при испарении, вызывает обморожение.
На производстве допустима максимальная концентрация аммиака в воздушной массе 20 мг/м³. Предельная среднесуточная концентрация вещества в помещении — 0,04 мг/м³. Допустима разовая концентрация аммиака в воздухе — 0,2 мг/м³. Если нормы превышаются, то в воздухе ощущается запах аммиака.
Когда в воздухе содержится 280 мг/м³, то раздражается зев, 490 мг/м³ — глаза, от 7 г/м³ — кожный покров. Легкие отекают, если аммиак в концентрации 1,5 г/м³ воздействует на человека в течение часа. Если кратковременно воздействовать аммиаком с содержанием в воздухе от 3,5 г/м³, то неизбежны общетоксические поражения.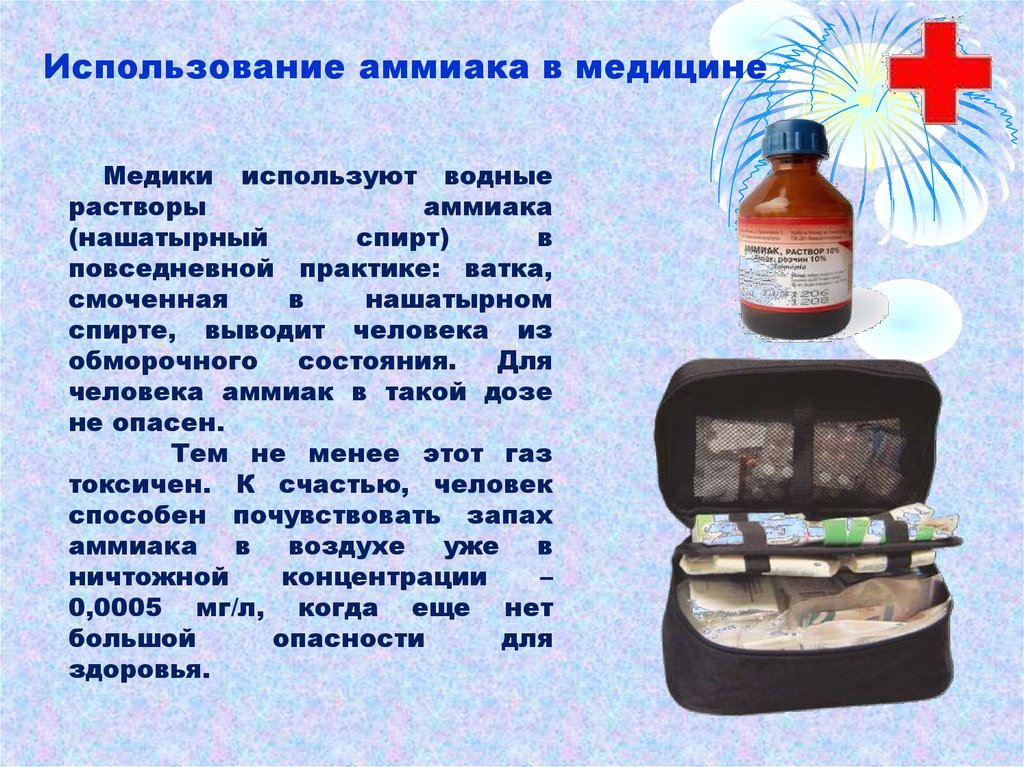
Хотите получить консультацию?
Позвоните нам по телефону!
+7 (495) 532 17 17 Пн.-Пт. с 9:00 до 18:00, обед с 13:00 до 14.00, Сб. с 9.00 до 15:00
Некоторые факты об аммиаке
- Пары нашатырного спирта (раствора аммиака в воде) могут менять окраску цветов. Лепестки синих оттенков они делают зелеными, насыщенно-красные — чернят.
- Аммиак наполняет облака над Юпитером.
- Не пахнущие в естественной среде цветы после воздействия на них аммиаком источают приятный аромат. К таким цветам относятся астры.
- Нашатырь, взаимодействуя с йодом, образует йодистый азот в виде кристаллов, таким образом проводят химические опыты с наглядными результатами.
Источники:
- https://ru.wikipedia.org/wiki/Аммиак
- Общая и неорганическая химия. Н. С. Ахметов
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
Как образуется аммиак?
При соединении водорода и азота.
Аммиак — это опасное вещество?
По классификации ГОСТ 12. 1.007 это вещество признается малоопасным.
1.007 это вещество признается малоопасным.
Где применяют аммиак?
Для производства удобрений, полимеров, соды, в холодильных установках, медицине и других сферах.
Как аммиак действует на человека?
Пары аммиака раздражают слизистую и кожу, возможен химический ожог. При длительном вдыхании провоцируют отек легких и удушье.
Если вам понравилась статья, поделитесь ей в социальных сетях
Аммиак — Американское химическое общество
Аммиак — бесцветный ядовитый газ со знакомым ядовитым запахом. Это происходит в природе, в основном в результате анаэробного распада растительного и животного сырья; и он также был обнаружен в космосе. Некоторые растения, в основном бобовые, в сочетании с бактериями-ризобиями «фиксируют» атмосферный азот с образованием аммиака.
Аммиак известен своим запахом с древних времен. Он был выделен в 18 веке известными химиками Джозефом Блэком (Шотландия), Питером Вульфом (Ирландия), Карлом Вильгельмом Шееле (Швеция/Германия) и Джозефом Пристли (Англия). В 1785 году французский химик Клод Луи Бертолле определил его химический состав.
В 1785 году французский химик Клод Луи Бертолле определил его химический состав.
Аммиак производится в промышленных масштабах посредством каталитической реакции азота и водорода при высокой температуре и давлении. Процесс был разработан в 1909 году немецкими химиками Фрицем Габером и Карлом Бошем. Оба получили Нобелевскую премию по химии за свою работу, но в разные годы: Габер в 1918 году и Бош в 1931 году. Фундаментальный процесс Габера-Боша используется до сих пор.
В 2020 году мировые мощности по производству аммиака составили 224 миллиона тонн (Мт). Фактический объем производства составил 187 млн т. Он занимает девятое место среди химикатов, производимых в мире.
Большая часть производимого аммиака — ≈85% — прямо или косвенно используется в сельском хозяйстве. Химические удобрения, изготовленные из аммиака, включают мочевину, фосфат аммония, нитрат аммония и другие нитраты. Другие важные химические вещества, получаемые из аммиака, включают азотную кислоту, гидразин, цианиды и аминокислоты.
Аммиак когда-то широко использовался в качестве хладагента. Он был в значительной степени вытеснен хлорфторуглеродами и гидрохлорфторуглеродами, которые также находятся под пристальным вниманием со стороны окружающей среды. Вероятно, самое известное применение аммиака в быту – это средства для мытья стекол.
Аммиак хорошо растворим в воде; его точная растворимость зависит от температуры (см. быстрые факты). Водный аммиак также называют гидроксидом аммония, но эту молекулу нельзя выделить. Когда аммиак используется в качестве лиганда в координационных комплексах, его называют «аммином».
В настоящее время аммиак производится из водорода, полученного из ископаемого топлива, и поэтому не является «зеленым» продуктом, несмотря на его широкое использование в сельском хозяйстве. Но экологически чистый аммиак может появиться на горизонте, если водород будет производиться другими способами, такими как электролиз воды с помощью ветра или солнечной энергии.
Аммиак можно сжигать в качестве топлива в стандартных двигателях. Исследование, проведенное компанией-производителем катализаторов Haldor Topsoe (Kongens Lyngby, Дания), показало, что замена обычного судового топлива зеленым аммиаком будет рентабельной и устранит значительный источник парниковых газов. Потенциально его также можно использовать в авиационном топливе. В переходный период аммиак можно будет смешивать с обычным топливом.
Исследование, проведенное компанией-производителем катализаторов Haldor Topsoe (Kongens Lyngby, Дания), показало, что замена обычного судового топлива зеленым аммиаком будет рентабельной и устранит значительный источник парниковых газов. Потенциально его также можно использовать в авиационном топливе. В переходный период аммиак можно будет смешивать с обычным топливом.
| Класс опасности* | Краткая характеристика опасности | |
|---|---|---|
| Газы под давлением, сжиженный газ | h380 — содержит газ под давлением; может взорваться при нагревании | |
| Разъедание/раздражение кожи, категория 1B | h414 — вызывает сильные ожоги кожи | |
| Серьезное повреждение/раздражение глаз, категория 1 | h418 — вызывает серьезное повреждение глаз | |
| Острая токсичность при вдыхании, категория 3 | h431 — Токсично при вдыхании | |
| Опасность для водной среды, острая опасность, категория 1 | h500 — очень токсичен для водных организмов | |
| Опасность для водной среды, долговременная опасность, категория 2 | h511 — Токсично для водных организмов с долгосрочными последствиями | |
*Глобально согласованная система классификации и маркировки химических веществ.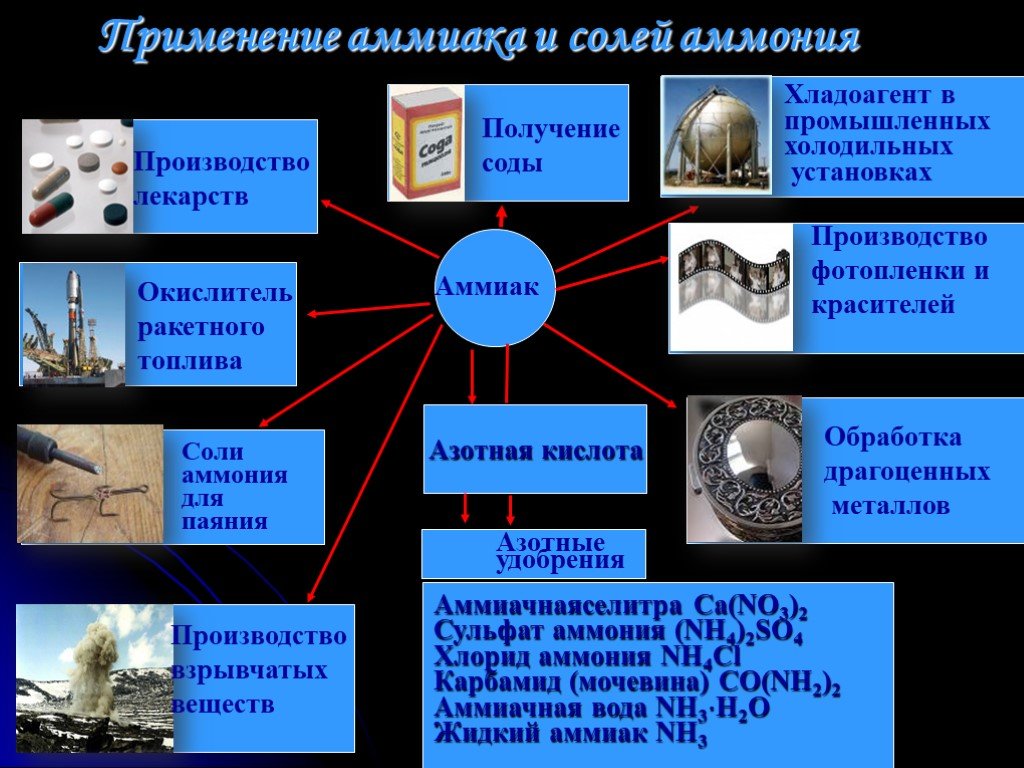 Пояснения к пиктограммам.
Пояснения к пиктограммам.
Обновление MOTW
L -Триптофан был Молекулой недели 20 ноября 2017 года. Это незаменимая аминокислота, которая должна быть частью рациона человека. Помимо других функций, он позволяет организму синтезировать серотонин и мелатонин. Недавно триптофан появился в двух биохимических исследованиях.
В одном исследовании исследователи из Университета штата Пенсильвания (Университетский парк) и Массачусетского технологического института (Кембридж) обнаружили, что фермент триптофан 2C метилтрансфераза, который катализирует добавление метильной группы к индольному кольцу триптофана в синтезе антибиотика тиострептона , не использует радикальный механизм, как большинство ферментов этого класса. Вместо этого карбоксилатная группа в ферменте действует как общее основание для депротонирования триптофанового субстрата.
Во втором исследовании А. Кит Дункер из Университета Индианы (Блумингтон) и Клара Хлухова из Карлова университета (Прага) вместе пытались выяснить, как зародилась жизнь на Земле.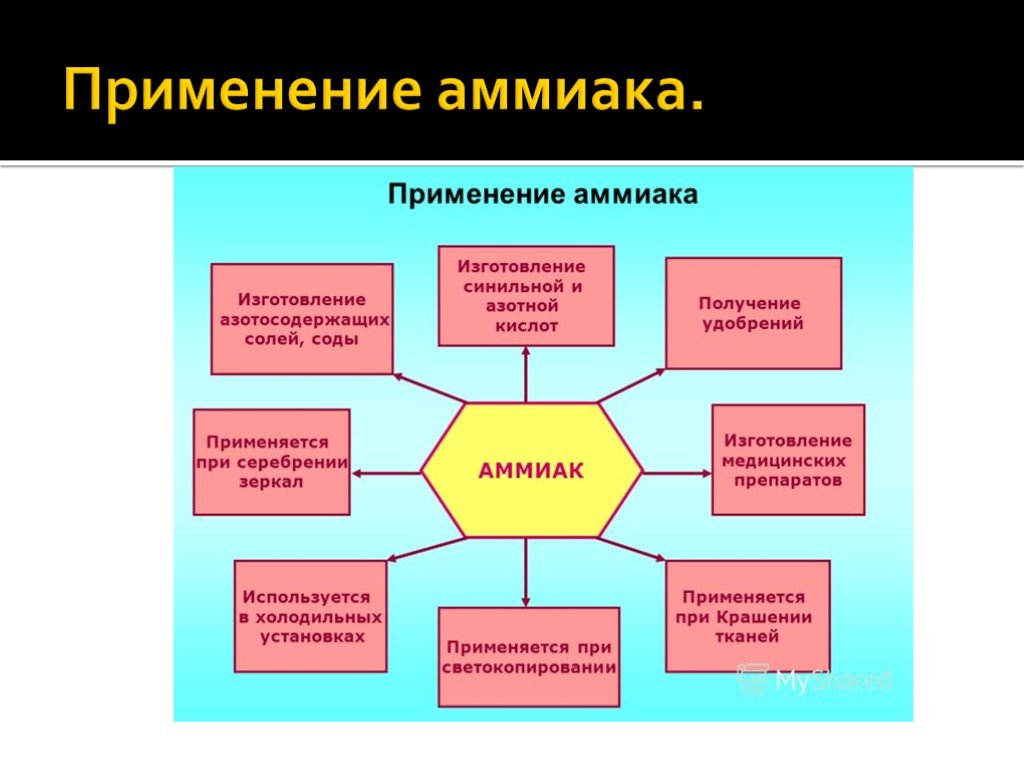 Они предположили, что изначально неупорядоченные белки (IDP), которые не придерживаются определенной конформации, а перемещаются, были вовлечены в этот процесс на ранней стадии. Они считают, что неструктурированные белки, образованные IDP, в конечном итоге были дополнены образующимися позже ароматическими аминокислотами триптофаном и тирозином, которые крупнее и придают белкам большую степень структуры. Они проверили свои идеи, заменив ароматические аминокислоты в ключевом ферменте лейцином; модифицированный, менее структурированный фермент сохранил некоторую активность, но в конечном итоге не работал так же эффективно, как исходный.
Они предположили, что изначально неупорядоченные белки (IDP), которые не придерживаются определенной конформации, а перемещаются, были вовлечены в этот процесс на ранней стадии. Они считают, что неструктурированные белки, образованные IDP, в конечном итоге были дополнены образующимися позже ароматическими аминокислотами триптофаном и тирозином, которые крупнее и придают белкам большую степень структуры. Они проверили свои идеи, заменив ароматические аминокислоты в ключевом ферменте лейцином; модифицированный, менее структурированный фермент сохранил некоторую активность, но в конечном итоге не работал так же эффективно, как исходный.
Факты об аммиаке
| CAS Reg. № | 7664-41-7 |
| SciFinder номенклатура | Аммиак |
| Эмпирическая формула | Н 3 Н |
| Молярная масса | 17,03 г/моль |
| Внешний вид | Бесцветный газ |
| Температура кипения | –33,3 °С |
| Растворимость в воде | ≈530 г/л (20 ºC) ≈320 г/л (25 ºC) |
Обновление MOTW:
15 марта 2021 г.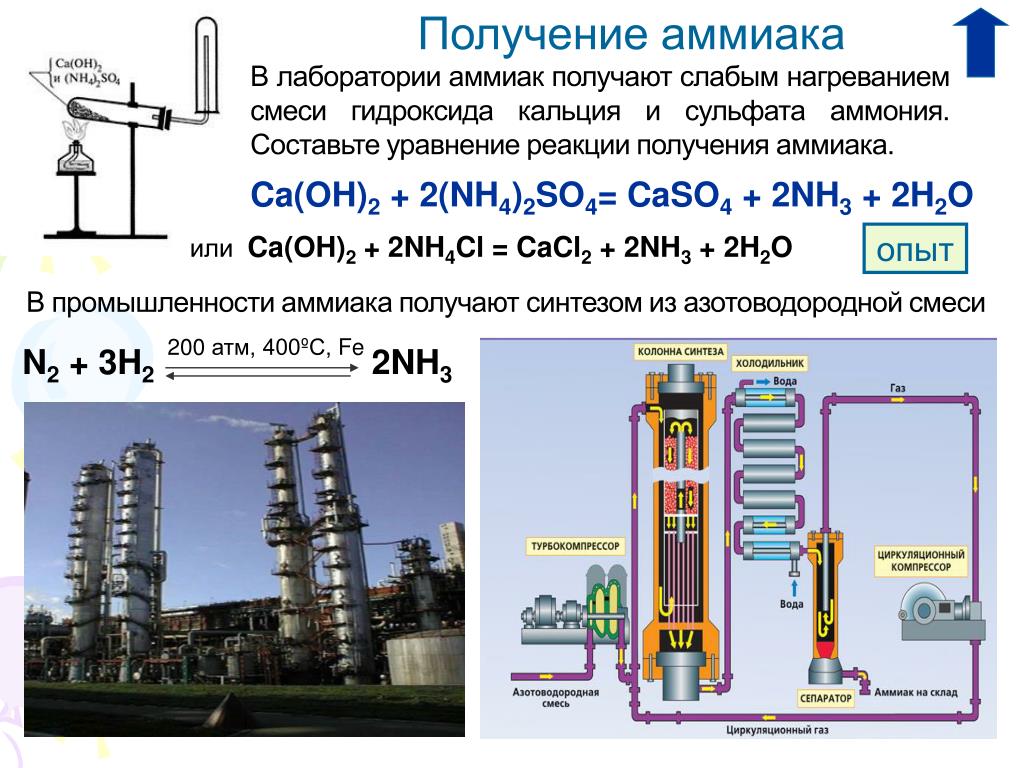
Аммиак в основном используется в сельском хозяйстве, но теперь он может иметь более «зеленое» применение — в качестве топлива для транспорта. На прошлой неделе статья в Chemical & Engineering News представила промышленное обновление вариантов и препятствий, которые определят , действительно ли аммиак является «топливом будущего».
Вода и воздух — это все, что вам нужно для производства аммиака — одного из самых важных химических веществ в мире
Более зеленые удобрения идут к вам. Предоставлено: Джеймс Т.М. Товилл, CC BY-SA.
Исследователи разработали метод получения аммиака просто из воздуха и воды. Он не только более энергоэффективен, чем столетний процесс Габера-Боша, который в настоящее время используется во всем мире, но и более экологичный.
Аммиак, состоящий из трех частей водорода и одной части азота (или NH 3 ), оказал огромное влияние на общество. По оценкам, без массового производства этого химического вещества треть из нас не выживет.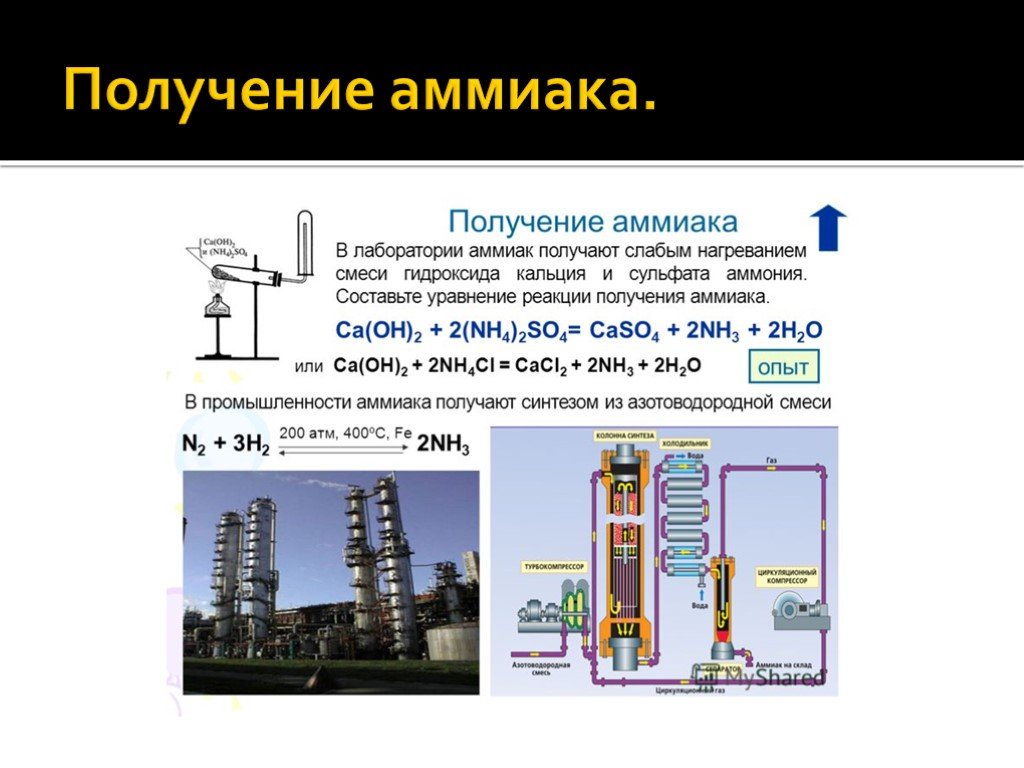 Это связано с тем, что его основное использование — производство удобрений, которые помогли повысить урожайность и поддерживать большую популяцию.
Это связано с тем, что его основное использование — производство удобрений, которые помогли повысить урожайность и поддерживать большую популяцию.
Разработанный в 1909 году процесс Габера-Боша, который часто называют наиболее важным изобретением 20-го века, включает нагревание очищенных газообразных азота и водорода при очень высокой температуре и давлении в присутствии железного катализатора. Необходимо наличие катализатора, который не участвует в реакции, но снижает энергетический порог реакции. Несмотря на это, производство аммиака – около 140 млн тонн в 2012 году – потребляет почти 2% мировых энергоресурсов.
Помимо больших энергетических потребностей для достижения условий реакции, текущий метод производства неэффективен, поскольку для него требуется газообразный водород, который получают путем переработки природного газа. Побочным продуктом процесса является углекислый газ. Стюарт Лихт и его коллеги из Университета Джорджа Вашингтона считали, что они могли бы добиться большего успеха, если бы нашли способ использовать воду вместо природного газа в качестве источника водорода.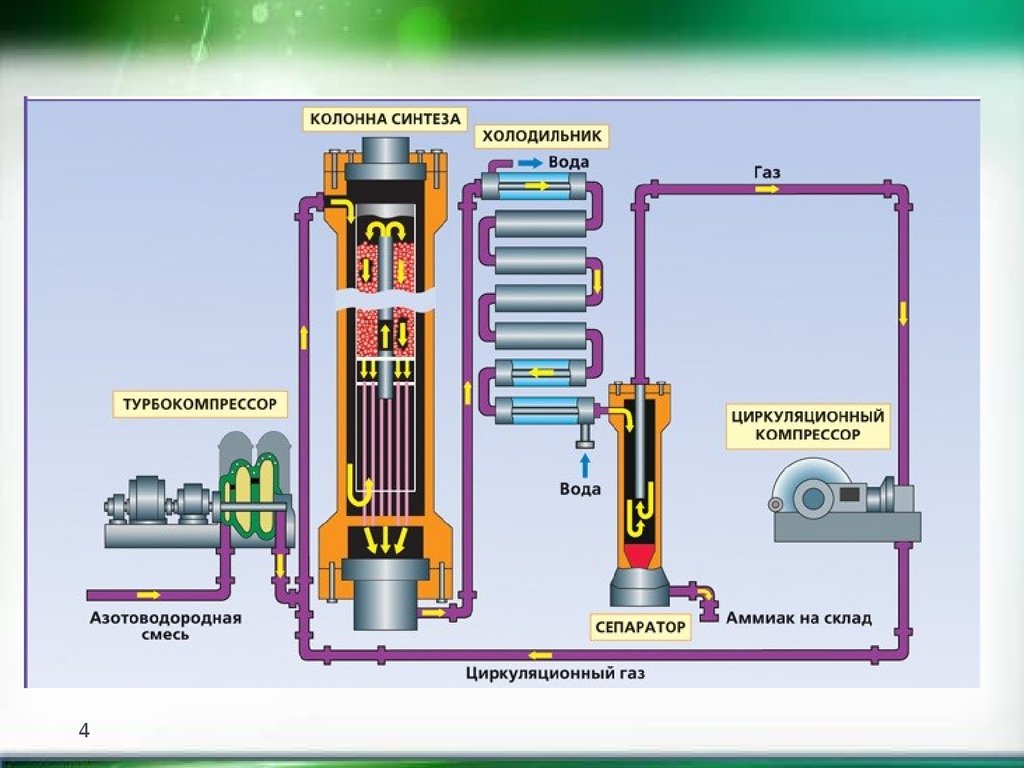
Предыдущие попытки объединить воду (состоящую из двух частей водорода и одной части кислорода) с воздухом (который состоит из 78% азота) для образования аммиака были менее успешными. Решение Лихта состояло в том, чтобы пропускать влажный воздух через смесь крошечных частиц оксида железа и расплавленных химикатов (состоящих из гидроксидов натрия и калия), которые были поражены электричеством.
Любая химическая реакция представляет собой обмен электронами между атомами. В этом случае эти электроны необходимы, чтобы отделить водород от воды, а затем соединиться с азотом. «При подаче электричества оксид железа захватывает электроны, позволяя воде и воздуху напрямую реагировать с образованием аммиака», — сказал Лихт.
Утверждается, что этот метод использует только две трети энергии процесса Габера-Боша. Наряду с устранением необходимости производить водород из природного газа общие выбросы снижаются довольно значительно. Весь процесс также происходит в более мягких условиях, не требующих температуры 450°C и давления, в 200 раз превышающего атмосферное, как в процессе Габера-Боша.
Это не все, что делает метод Лихта привлекательным. Часть энергии поступает с помощью другой технологии, разработанной Лихтом, которая называется солнечным термоэлектрохимическим производством или STEP. Он считается одним из самых эффективных солнечных элементов, используемых в настоящее время. STEP при производстве аммиака приводит к производству водорода в качестве побочного продукта.
Этот побочный продукт подходит для водородных топливных элементов, еще одного популярного направления для энтузиастов чистой энергии, по словам Дэвида Фермина, профессора электрохимии Бристольского университета. «Водород, полученный таким образом, значительно чище», — сказал он.
Однако одно дело — демонстрировать успех химического производства в лабораториях, и совсем другое — воспроизвести его в промышленных масштабах. Лихт признает, что есть возможности для улучшения, но он уверен, что это сработает. У Фермина есть предостережение, чтобы добавить: «Прежде чем переходить к полномасштабному масштабированию, потребуется лучшее понимание механизма этой сложной реакции переноса нескольких электронов».
Но даже с методом Лихта, отмечает Фермин, мы далеки от того, чтобы воспроизвести естественную эффективность преобразования азота из воздуха в полезные химические вещества, что делают азотфиксирующие бактерии. «Что действительно примечательно, так это то, что природа делает это невероятно эффективно при низких температурах», — добавил Фермин.
И все же, если что-то более эффективное сможет заменить процесс Габера-Боша, это снизит энергозатраты на производство одного из самых важных химических веществ в мире и приведет к заметному сокращению глобальных выбросов CO 2 выбросы.
Дополнительная информация:
«Синтез аммиака с помощью N2 и паровой электролиз в суспензиях расплавленных гидроксидов наноразмерного Fe2O3», S. Licht et al. Наука, www.sciencemag.org/lookup/doi/… 1126/science.1254234
Источник:
Разговор
Эта история опубликована с разрешения The Conversation (под лицензией Creative Commons-Attribution/Без производных).