Содержание
Аммиак — Что такое Аммиак?
, Обновлено 21 января 11:52
231614
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом.
Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость Nh4 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость.
Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподеленных электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвленную сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твердый аммиак — кубические кристаллы.
#Аммиак
Последние новости
Азот — степени окисления, свойства и реакции
Поможем понять и полюбить химию
Начать учиться
В этой статье мы рассмотрим характеристики азота в химии, узнаем, какие степени окисления может иметь азот и поговорим о важнейших соединениях, в состав которых входит этот химический элемент.
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
youtube.com/embed/wBrC6oI6M8c» title=»YouTube video player» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» ssmarticle=»»>
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
с фтором
N2 + F2 = 2NF3с кислородом
N2 + O2 = 2NO
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.

Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2Oразложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака.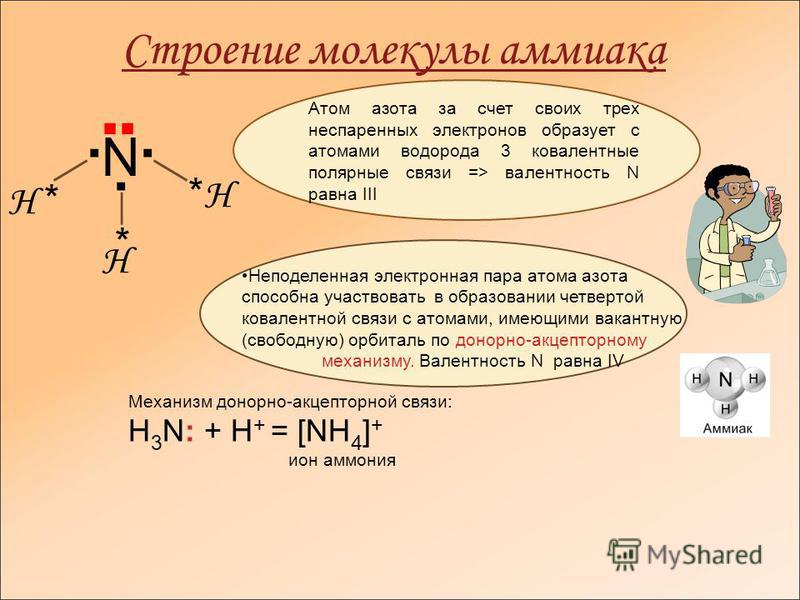 Различают два типа способов: промышленный и лабораторный.
Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2OОкисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.

Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
V,
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.

Не участвует в реакциях с изменением степеней окисления.
Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Ответы
c
a
c
b
c
Ксения Боброва
К предыдущей статье
Теория электролитической диссоциации
К следующей статье
Электролиз расплавов и растворов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
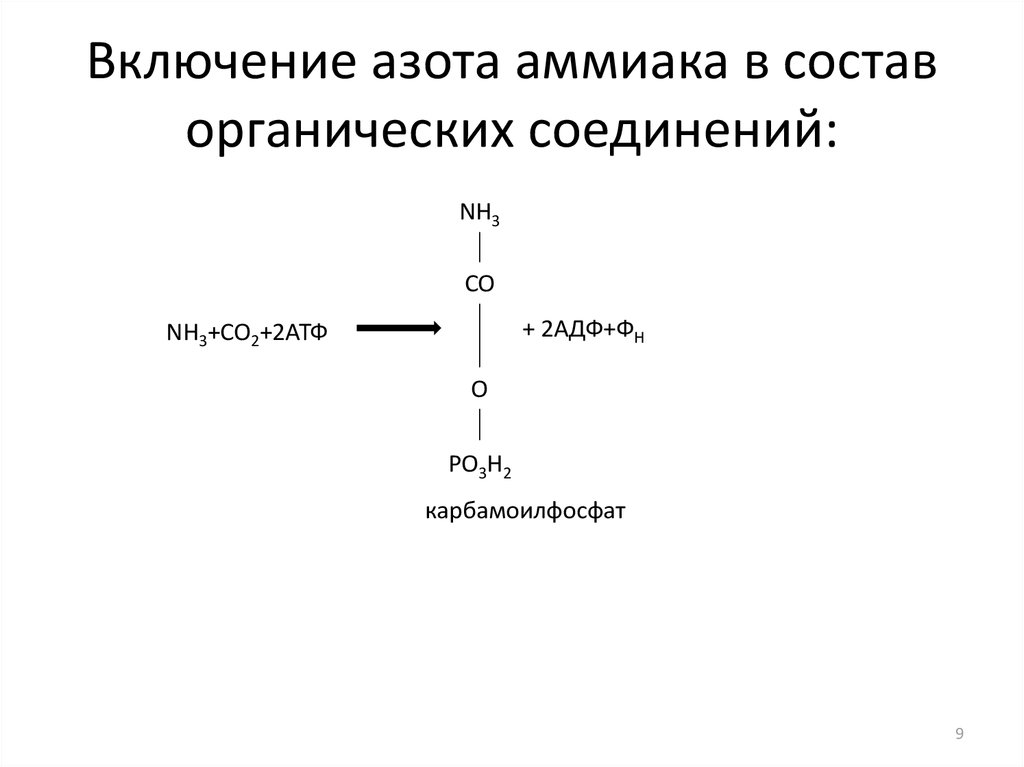
Многофункциональный композитный носитель азота для производства аммиака по циклическому химическому маршруту
Шэн
Фэн,‡ аб
Венбо
Гао,‡ б
Цяньру
Ван, б
Ецинь
Гуань, б
Ханьсюэ
Ян, 9 лет0003 б
Хан
Ву, б
Худжун
Цао,
* б
Цзяньпин
Го
* б
и
пинг
Чен аб
Принадлежности автора
*
Соответствующие авторы
и
Химическая школа Чжан Даюй, Даляньский технологический университет, Далянь, Китай
б
Даляньская национальная лаборатория чистой энергии, Ключевая государственная лаборатория катализа, Совместный инновационный центр химии энергетических материалов, Даляньский институт химической физики, Китайская академия наук, Далянь, Китай
Электронная почта:
guojianping@dicp. ac.cn, [email protected]
ac.cn, [email protected]
Аннотация
Химический цикл привлекает все большее внимание как альтернативный подход к устойчивому синтезу аммиака. Азотоносители с высокой эффективностью являются ключом к практической осуществимости и конкурентоспособности этого подхода. Здесь был идентифицирован многофункциональный композитный носитель азота, состоящий из нитридов Mn и имидов щелочных или щелочноземельных металлов (Li 2 NH или BaNH), и он опосредовал двухступенчатую химическую петлю через N 2 фиксация нитридом марганца с низким содержанием азота и гидридом щелочного или щелочноземельного металла, а также гидрирование нитрида марганца с высоким содержанием азота и имидов щелочного или щелочноземельного металла до аммиака. Отличительные особенности этого нитрид-имидного композитного носителя азота заключаются в том, что: 1. нитрид марганца действует не только как носитель азота, но и действует как катализатор, значительно улучшая кинетику связывания N 2 гидридом с образованием имида и последующее гидрирование имида до аммиака и гидрида; и 2. гидриды, с другой стороны, также облегчают кинетику N 2 фиксация и последующее гидрирование нитрида марганца. Эти особенности делают контур высокоэффективным в мягких условиях, т.е. , при атмосферном давлении и температурах ниже 300 °C; композитный носитель азота Mn 2 N-BaNH может образовывать петлю со скоростью образования аммиака более чем на порядок выше, чем скорость образования чистого BaNH и Mn 2 N соответственно. Такая скорость производства аммиака может быть достигнута только с помощью термокаталитического процесса, катализируемого промотированным Cs Ru/MgO, при более высоких температуре и давлении. Эта работа открывает возможности для проектирования и разработки новых типов носителей азота с множеством компонентов и функций.
нитрид марганца действует не только как носитель азота, но и действует как катализатор, значительно улучшая кинетику связывания N 2 гидридом с образованием имида и последующее гидрирование имида до аммиака и гидрида; и 2. гидриды, с другой стороны, также облегчают кинетику N 2 фиксация и последующее гидрирование нитрида марганца. Эти особенности делают контур высокоэффективным в мягких условиях, т.е. , при атмосферном давлении и температурах ниже 300 °C; композитный носитель азота Mn 2 N-BaNH может образовывать петлю со скоростью образования аммиака более чем на порядок выше, чем скорость образования чистого BaNH и Mn 2 N соответственно. Такая скорость производства аммиака может быть достигнута только с помощью термокаталитического процесса, катализируемого промотированным Cs Ru/MgO, при более высоких температуре и давлении. Эта работа открывает возможности для проектирования и разработки новых типов носителей азота с множеством компонентов и функций.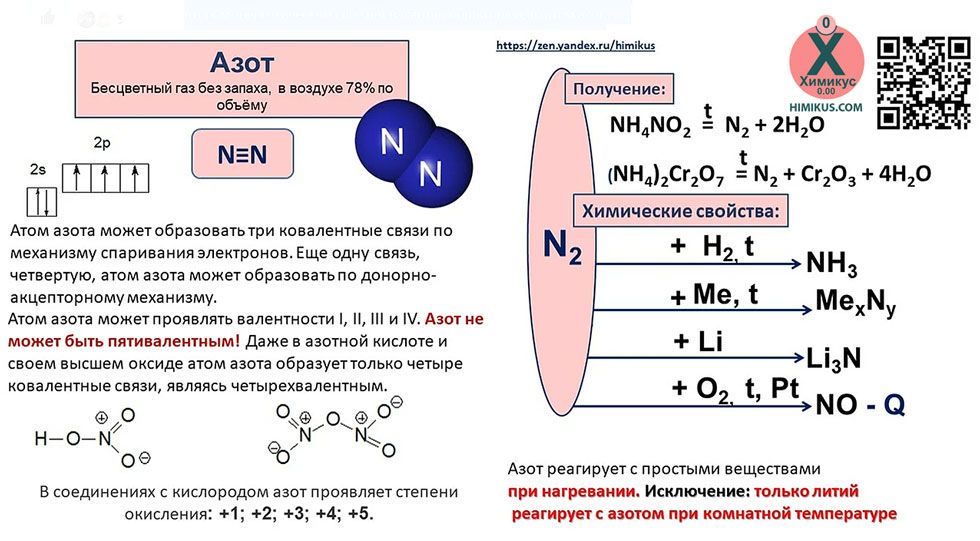
Качество воды в аквариуме: круговорот азота / Аквариумные рыбы / Отдых и досуг / Потребительские ресурсы / Дом
Аммиак
Аммиак образуется в результате метаболизма белка и является основным продуктом жизнедеятельности рыб. Большая часть аммиака из рыб выделяется через жабры, при этом относительно небольшая его часть теряется с мочой и фекалиями. Аммиак также образуется при разложении несъеденного корма или другой органики в аквариуме. Высокие концентрации аммиака в воде затрудняют выведение аммиака из организма рыб. Это накопление аммиака может вызвать стресс, повреждение жабр и внутренних органов и, в конечном итоге, смерть.
Суммарный аммиак состоит из двух компонентов: неионизированного аммиака (Nh4) и ионизированного аммиака (Nh5+). Неионизированный аммиак чрезвычайно токсичен для рыб, тогда как ионизированный аммиак — нет. Соотношение неионизированного и ионизированного аммиака меняется в зависимости от pH и температуры воды. По мере увеличения pH или температуры большая часть аммиака переходит в неионизированную, токсичную форму. Неионизированный аммиак начинает вызывать повреждение жабр примерно при 0,05 мг/л и смерть примерно при 2,0 мг/л. Имейте в виду, что большинство тестовых наборов измеряют общий аммиак, а не неионизированный аммиак, но могут не учитывать разницу. Для расчета доли неионизированного аммиака от общего аммиака используется таблица.
По мере увеличения pH или температуры большая часть аммиака переходит в неионизированную, токсичную форму. Неионизированный аммиак начинает вызывать повреждение жабр примерно при 0,05 мг/л и смерть примерно при 2,0 мг/л. Имейте в виду, что большинство тестовых наборов измеряют общий аммиак, а не неионизированный аммиак, но могут не учитывать разницу. Для расчета доли неионизированного аммиака от общего аммиака используется таблица.
Аммиак удаляется из аквариумной системы с помощью биофильтра. Биофильтр обеспечивает субстрат, на котором растут нитрифицирующие бактерии. Эти нитрифицирующие бактерии потребляют аммиак и производят нитрит, который также токсичен для рыб. Другие нитрифицирующие бактерии в биофильтре потребляют нитриты и производят нитраты. Нитрат не токсичен для большинства пресноводных рыб, за исключением высоких уровней, и его можно достаточно снизить за счет периодических подмен воды. Некоторые нитраты также будут усваиваться растениями. В природных системах и некоторых аквариумных системах нитраты превращаются в газообразный азот денитрифицирующими бактериями.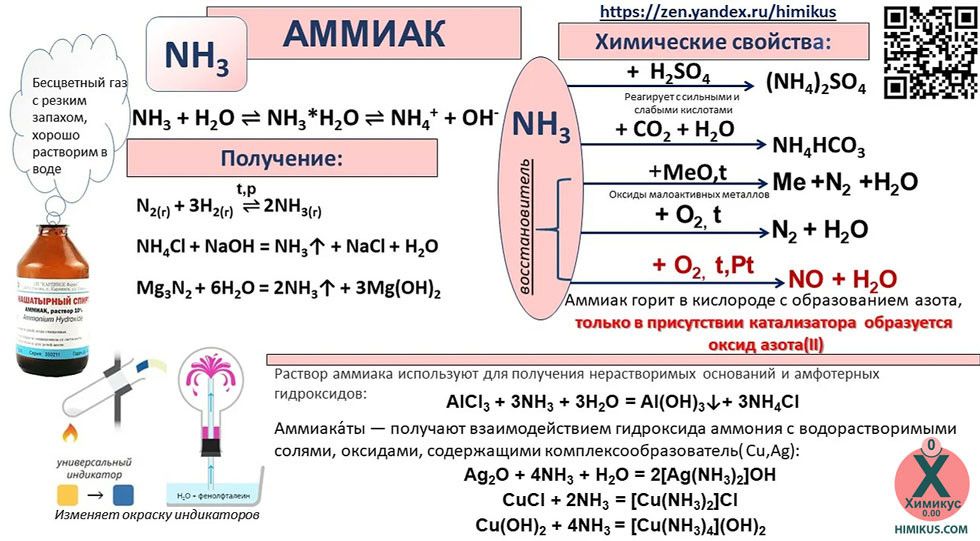 Это преобразование аммиака в нитриты, нитраты и газообразный азот известно как азотный цикл.
Это преобразование аммиака в нитриты, нитраты и газообразный азот известно как азотный цикл.
Нитрифицирующие бактерии, хотя они естественным образом присутствуют в окружающей среде, требуют времени для накопления на биофильтрующем носителе, прежде чем они смогут эффективно удалять все отходы, производимые рыбой. Установка аквариума и заполнение его рыбой в тот же день или даже в течение недели или двух — верный путь к катастрофе. Бактериям в биофильтре может потребоваться от трех до восьми недель для цикла (т. Е. Приживания) при температуре 77-80 градусов по Фаренгейту; даже больше времени может потребоваться при более низких температурах. Аквариумисты могут начать циклический процесс, используя один или несколько из следующих методов:
- Добавление чистого непенящегося аммиака в домашних условиях непосредственно в систему до уровня 23 мг/л добавление нескольких особей вида рыб, которые могут выдерживать начальные высокие уровни аммиака и нитритов, перед добавлением последних видов, подлежащих содержанию .

- Заполнение системы/биофильтра водой или субстратом, содержащим бактерии из «здоровой» установленной системы.
- Засев системы бактериями из надежного коммерческого источника.
В процессе работы биофильтра количество аммиака будет повышаться до тех пор, пока не появится достаточное количество нитрифицирующих бактерий, которые поглощают аммиак и превращают его в нитриты. Затем уровень аммиака начнет снижаться, а уровень нитрита увеличится. Уровни нитритов будут продолжать расти до тех пор, пока не появится достаточное количество бактерий, которые поглощают нитрит и превращают его в нитрат. Если не будет много растений, уровень нитратов будет расти медленно, пока не будет произведена подмена воды. Тесты на аммиак и нитриты следует проводить каждые несколько дней до тех пор, пока уровень аммиака, а затем уровень нитрита не поднимется и не упадет (т. е. цикл). Резервуары, которые заселены до того, как биофильтр заработает должным образом, часто становятся мутными из-за сильного цветения ненитрифицирующих бактерий.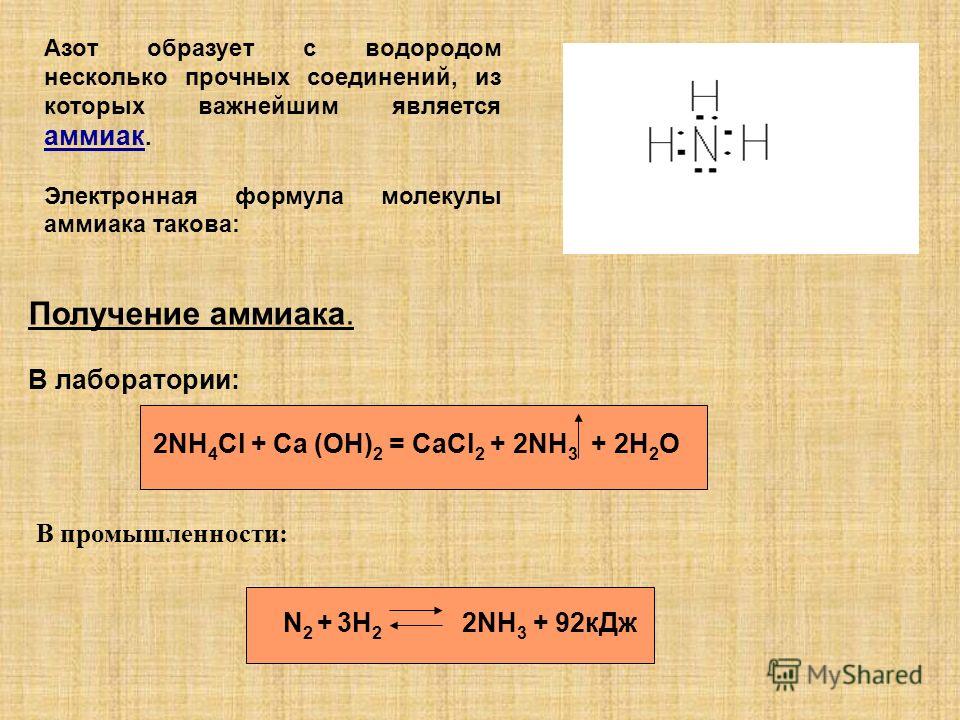
После периода циклирования аммиак следует проверять один раз в неделю. После установки хорошо управляемый аквариум не должен иметь определяемых уровней аммиака. При наличии аммиака необходимо оценить содержание аквариума, чтобы убедиться, что:
- Биофильтр достаточно большой.
- Биофильтр не требует очистки.
- Аквариумист не перекармливает (исходя из того, что может выдержать биофильтр, а не того, что съест рыба).
- Резервуар не перегружен.
- Бак не слишком загрязнен.
- Биофильтр не слишком чистый (сильная очистка биофильтра удалит нитрифицирующие бактерии).
- Щелочность или pH не упали и не оказали негативного влияния на биофильтр
- Химические вещества, убивающие бактерии в биофильтре, не использовались.
Нитрит
Нитрит образуется при превращении аммиака нитрифицирующими бактериями. Нитрит токсичен для рыб, поскольку он связывается с гемоглобином в крови рыб с образованием метгемоглобина. Гемоглобин переносит кислород по телу, а метгемоглобин — нет, поэтому рыба в воде с высоким содержанием нитритов может задохнуться, даже если присутствует достаточное количество кислорода. Если в крови рыбы присутствует достаточное количество метгемоглобина, кровь становится коричневой, а не красной. Следовательно, токсичность нитритов часто называют «болезнью коричневой крови».
Гемоглобин переносит кислород по телу, а метгемоглобин — нет, поэтому рыба в воде с высоким содержанием нитритов может задохнуться, даже если присутствует достаточное количество кислорода. Если в крови рыбы присутствует достаточное количество метгемоглобина, кровь становится коричневой, а не красной. Следовательно, токсичность нитритов часто называют «болезнью коричневой крови».
При наличии нитритов следует произвести подмену воды. Если виды рыб в аквариуме будут терпеть повышенную соленость, в аквариум можно добавить соль, чтобы повысить уровень хлоридов в воде. Уровень хлоридов должен быть как минимум в шесть раз выше уровня нитритов. Хлорид предотвращает поглощение нитритов кровью рыб, тем самым устраняя последствия заболевания коричневой крови. Однако добавление соли/хлорида не удаляет нитрит из системы, поэтому необходимо контролировать источник нитрита.
После периода циклирования нитрит необходимо проверять один раз в неделю. После установки хорошо управляемый аквариум не должен содержать обнаруживаемых уровней нитритов. Если присутствует нитрит, необходимо оценить содержание аквариума, чтобы убедиться, что:
Если присутствует нитрит, необходимо оценить содержание аквариума, чтобы убедиться, что:
- Биофильтр достаточно большой.
- Биофильтр не требует очистки.
- Аквариумист не перекармливает (исходя из того, что может выдержать биофильтр, а не того, что съест рыба).
- Резервуар не перегружен.
- Бак не слишком загрязнен.
- Биофильтр не слишком чистый (сильная очистка биофильтра удалит нитрифицирующие бактерии).
- Щелочность или pH не снизились и не оказали негативного влияния на биофильтр.
- Химикаты, убивающие бактерии в биофильтре, не использовались.
Нитрат
Нитрат образуется при расщеплении нитрита нитрифицирующими бактериями. За исключением очень высоких концентраций, нитрат не токсичен для большинства пресноводных рыб. Нитраты могут поглощаться растениями или удаляться из воды при периодической подмене воды. В природных системах и некоторых аквариумных системах нитраты превращаются в газообразный азот денитрифицирующими бактериями.
Газообразный азот
Газообразный азот может быть получен в аквариуме путем преобразования нитратов. Однако это часто вызывает больше беспокойства в некоторых подземных источниках воды, особенно в воде из колодцев и источников, где азот может быть на уровне перенасыщения. Как и в случае с кислородом и углекислым газом, растворимость азота увеличивается с понижением температуры и солености и повышением давления. Давление снижается по мере того, как вода из колодца или родника достигает поверхности, и может удерживать меньше газообразного азота. Если эту воду налить непосредственно на рыбу, в жабрах, коже и плавниках могут образоваться пузыри, поскольку азот начнет выходить, пытаясь сравняться с азотом в атмосфере. Эта проблема, известная как болезнь газовых пузырей, похожа на изгибы у дайверов и может привести к смерти, если состояние тяжелое. Колодезная или родниковая вода должна быть дегазирована перед контактом с рыбой. Энергично аэрируйте воду с помощью воздушного насоса и аэратора в течение примерно 24 часов, прежде чем вода будет добавлена в резервуар, чтобы убедиться, что излишки газообразного азота удалены.