Содержание
Аммиак — Что такое Аммиак?
AИ-95
0
AИ-98
0
136574
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой Nh4, при нормальных условиях — бесцветный газ с резким характерным запахом.
Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость Nh4 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость.
Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподеленных электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвленную сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твердый аммиак — кубические кристаллы.
Последние новости
Новости СМИ2
Произвольные записи из технической библиотеки
Используя данный сайт, вы даете согласие на использование файлов cookie, помогающих нам сделать его удобнее для вас. Подробнее.
Подробнее.
Березниковский филиал ПНИПУ — АЗОТ. АММИАК. АММОНИЙ
В помощь учебному процессу и научно-исследовательской деятельности студентов библиотека БФ ПНИПУ предлагает вниманию тематический список литературы «АЗОТ. АММИАК. АММОНИЙ», подготовленный по материалам научных журналов, поступивших в фонд филиала в 2021 году.
- 55 лет славной истории. – Текст: непосредственный //Химическая промышленность сегодня. – 2021. — №3. – С.18-21.(ключевые слова: химическая компания «КуйбышевАзот», азотная промышленность, азот, химическое производство).
- Аксенчик, К.В. Эволюция и перспективы энерго- и ресурсосберегающих подходов в технологии аммиака / К.В.Аксенчик. — Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №1.- С.4-21. (ключевые слова: технология аммиака, аммиак, энергосбережение, ресурсосбережение, энергопотребление).
- Акулинин,Е.И. Короткоцикловая безнагревная адсорбция для извлечения водорода, кислорода и азота из газовых смесей: математическое моделирование, оптимизация режимов функционирования и проектирования установок/ Е.
 И.Акулинин, О.О.Голубятников, С.И.Дворецкий. – Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №11. – С.8-29.- на английском языке (ключевые слова: азот, адсорбция, математическое моделирование, водород, кислород, проектирование).
И.Акулинин, О.О.Голубятников, С.И.Дворецкий. – Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №11. – С.8-29.- на английском языке (ключевые слова: азот, адсорбция, математическое моделирование, водород, кислород, проектирование). - Бугаева, А.И. Модифицирование силикагеля комплексами никеля (II) с азот-и кислородсодержащими органическими лигандами для газовой хроматографии /А.И.Бугаева, Ю.Г.Слижов. — Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №1. – С.59-66. (ключевые слова: азот, газовая хроматография, сорбенты, модифицирование).
- Венгер, К.П. Оборудование для быстрого замораживания жидким азотом грунта, загрязненного нефтью для последующей утилизации / К.П.Венгер, В.А.Стефанова, О.А.Феськина. — Текст: непосредственный // Химическое и нефтегазовое машиностроение. – 2021. — №5. – С.23-25. (ключевые слова: азот, грунт, утилизация отходов, криогенная техника).
- Влияние меди на термическую устойчивость комплексных удобрений на основе нитрата аммония / К.
 Г.Горбовский, А.И.Казаков, А.М.Норов, А.И.Михайличенко. — Текст: непосредственный //Химическая технология. – 2021. — №6. – С.253-260. (ключевые слова: аммоний, нитрат аммония, микроэлементы, медь, комплексные удобрения).
Г.Горбовский, А.И.Казаков, А.М.Норов, А.И.Михайличенко. — Текст: непосредственный //Химическая технология. – 2021. — №6. – С.253-260. (ключевые слова: аммоний, нитрат аммония, микроэлементы, медь, комплексные удобрения). - Влияние степени нейтрализации фосфорной кислоты на свойства нитратсодержащих азотно-фосфорно-калийных удобрений /В.М.Колпаков, А.М.Норов, Д.А.Пагалешкин [и др.]. — Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №3. – С.52-58.(ключевые слова: минеральные удобрения, аммонизация кислот, нитрат аммония, химическое производство).
- Внедрение наилучших доступных технологий как способ повышения ресурсной, экологической и энергетической эффективности производств удобрений / А.С.Малявин, В.М.Костылева, А Ю.Попов, Е.Г.Кротова. – Текст: непосредственный //Химическая промышленность сегодня. – 2021. — №5. – С.18-21.(ключевые слова: химические удобрения, аммиак, схема производства, экология, эффективность производства).
- Елатонцев, Д.
 А. Сорбционное извлечение редкоземельных элементов на сульфокатионите КУ-2-8 из азотных растворов вскрытия лопаритового концентрата / Д.А.Елатонцев, А.П.Мухачев. — Текст: непосредственный //Химическая технология. – 2021. — №7. – С.312-317.(ключевые слова:азот, азотнокислый раствор, иониты, сорбция, редкоземельные элементы, химические исследования).
А. Сорбционное извлечение редкоземельных элементов на сульфокатионите КУ-2-8 из азотных растворов вскрытия лопаритового концентрата / Д.А.Елатонцев, А.П.Мухачев. — Текст: непосредственный //Химическая технология. – 2021. — №7. – С.312-317.(ключевые слова:азот, азотнокислый раствор, иониты, сорбция, редкоземельные элементы, химические исследования). - Захарян, Е.М. Пиролиз шин. Особенности процесса и состав продуктов реакции /Е.М.Захарян, А.Л.Максимов. – Текст: непосредственный //Журнал прикладной химии. – 2021. — №10-11. – С.1226-1264.( ключевые слова:шины, отходы шин, азот, азоторганические соединения, пиролиз).
- Илларионов, И.Е. Изучение, усовершенствование и оценка электрокоррозионной стойкости высокоэффективных ингибиторных композиций / И.Е.Илларионов, Ш.В.Садетдинов, В.Н.Гадалов. – Текст: непосредственный //Главный механик. – 2021. — №9. – С.54-61. (ключевые слова: азот, композиционные материалы, коррозия).
- Исследование возможности вскрытия датолитового концентрата сульфатом аммония / Г.
 Ф.Крысенко, Е.Э Дмитриева, Д.Г.Эпов [и др.]. — Текст: непосредственный //Химическая технология. – 2021. — №8. – С.338-344. (ключевые слова: аммоний, сульфат аммония, двойной сульфат аммония и кальция, двойной сульфат аммония и железа, выщелачивание).
Ф.Крысенко, Е.Э Дмитриева, Д.Г.Эпов [и др.]. — Текст: непосредственный //Химическая технология. – 2021. — №8. – С.338-344. (ключевые слова: аммоний, сульфат аммония, двойной сульфат аммония и кальция, двойной сульфат аммония и железа, выщелачивание). - Кунин, А.В. Закономерности механохимической гидрофобизации моноаммонийфосфата /А.В.Кунин. – Текст: непосредственный //Известия вузов. Химия и химическая технология. – 2021. — №2. – С.87-94. – на англий ском языке (ключевые слова: измельчение, моноаммонийфосфат, гидрофобизация, диоксид кремния).
- Лабыкин, А. Русской селитры хватит на всех /А.Лабыкин. – Текст: непосредственный //Эксперт. – 2021. — №44. – С.21-27.( ключевые слова: азотная промышленность, азотные удобрения, Уралхим).
- Михайловская, А.П. Сорбция активных красителей полисахаридами из водных растворов солей тетраалкиламмония / А.П.Михайловская, И.В.Елохин, С.С.Лысова. — Текст: непосредственный //Химическая технология. – 2021. — №11. – С.508-512.
 (ключевые слова: четвертичные аммониевые соли, сорбция, красители, полисахариды).
(ключевые слова: четвертичные аммониевые соли, сорбция, красители, полисахариды). - Получение диоксида титана из системы аммония гексафторотитанат – диоксид кремния /П.С.Гордиенко, Е.В.Пашнина, С.Б.Буланова [и др.]. – Текст: непосредственный //Химическая технология. – 2021. — №12. – С.530-542. (ключевые слова: термодинамика, гексафторотитанат аммония, диоксид титана, гексафторосиликат аммония, микроскопия).
- Романова, С.М. Исследование реакций взаимодействия азотнокислых эфиров целлюлозы с хлорангидридами карбоновых кислот / С.М.Романова, Л.А.Фатыхова.- Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №5.- С.30-34. (ключевые слова: азот, азотнокислые эфиры, целлюлоза, химическая модификация).
- Экстракционное получение азотнокислого раствора лантана марки «А» / А.А.Семенов, Б.Р.Кулагин, Е.В.Богатырев, А.С.Шиманец. — Текст: непосредственный //Химическая технология. – 2021. — №4. – С.176-182. (ключевые слова: азотнокислый раствор, катализаторы, осаждение, экстракция, редкоземельные элементы).

Март, 2022г
Разница между аммиаком и аммиачным азотом
Ключевое различие между аммиаком и аммиачным азотом заключается в том, что аммиак представляет собой неорганическое соединение, имеющее химическую формулу Nh4, тогда как аммиачный азот является мерой количества аммиака в образце.
Аммиак представляет собой газообразное соединение с характерным резким запахом. Хотя это полезно во многих случаях, это также токсичное соединение. Это распространенный токсичный загрязнитель в таких отходах, как сточные воды, навоз и т. д. Мы используем аммиачный азот для измерения количества этого токсичного соединения.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое аммиак
3. Что такое аммиачный азот
4. Сравнение бок о бок – аммиак и аммиачный азот в табличной форме
5. Резюме
Что такое аммиак?
Аммиак представляет собой неорганическое соединение, имеющее химическую формулу Nh4.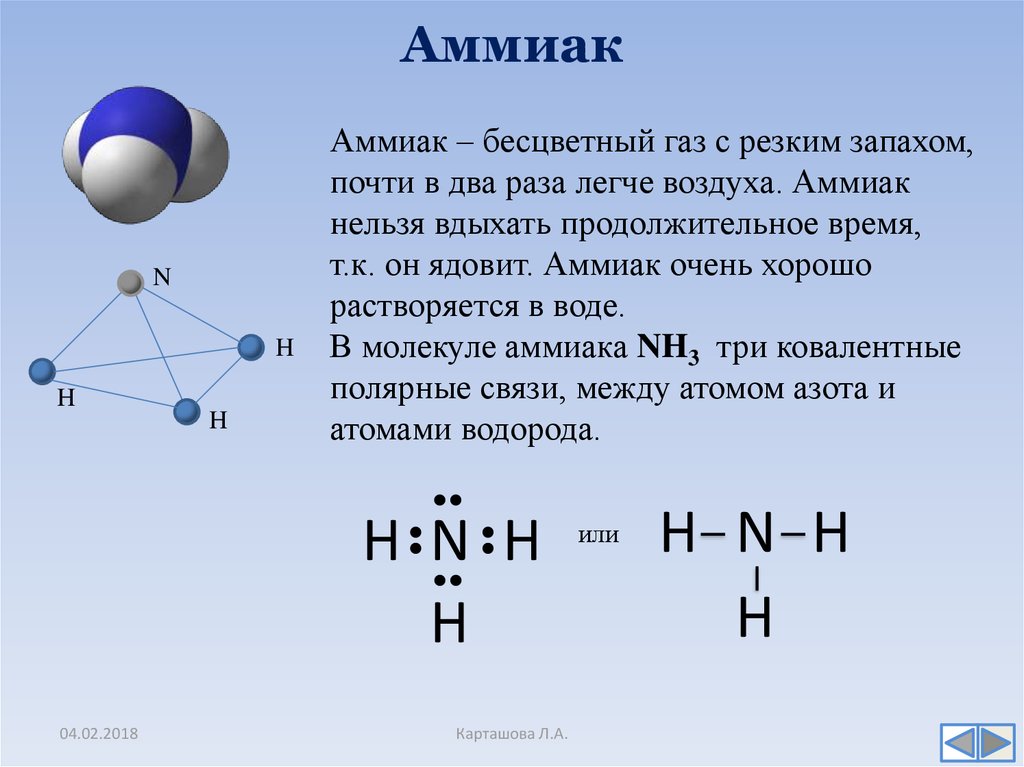 Следовательно, это газообразное соединение с характерным резким запахом. Название этого соединения по классификации ИЮПАК — азан. Молярная масса составляет 17 г/моль, а температура кипения составляет -33,34 °С. В одной молекуле аммиака один атом азота связан с тремя другими атомами водорода ковалентными связями. Более того, эта молекула имеет форму тригональной пирамиды и представляет собой бесцветный газ, который легче обычного воздуха.
Следовательно, это газообразное соединение с характерным резким запахом. Название этого соединения по классификации ИЮПАК — азан. Молярная масса составляет 17 г/моль, а температура кипения составляет -33,34 °С. В одной молекуле аммиака один атом азота связан с тремя другими атомами водорода ковалентными связями. Более того, эта молекула имеет форму тригональной пирамиды и представляет собой бесцветный газ, который легче обычного воздуха.
Рисунок 01: Химическая структура аммиака
Между молекулами аммиака существуют водородные связи. Поэтому мы можем легко сжижать этот газ. Это соединение распространено в азотистых отходах водных организмов. Более того, он способствует удовлетворению пищевых потребностей наземных организмов; за счет обеспечения потребностей в продуктах питания и удобрениях. Однако в концентрированном виде аммиак опасен и едок.
Что такое аммиачный азот?
Аммиачный азот является мерой количества аммиака в образце. Здесь мы определяем токсическое действие аммиака в свалочных фильтратах, отходах, таких как навоз и т.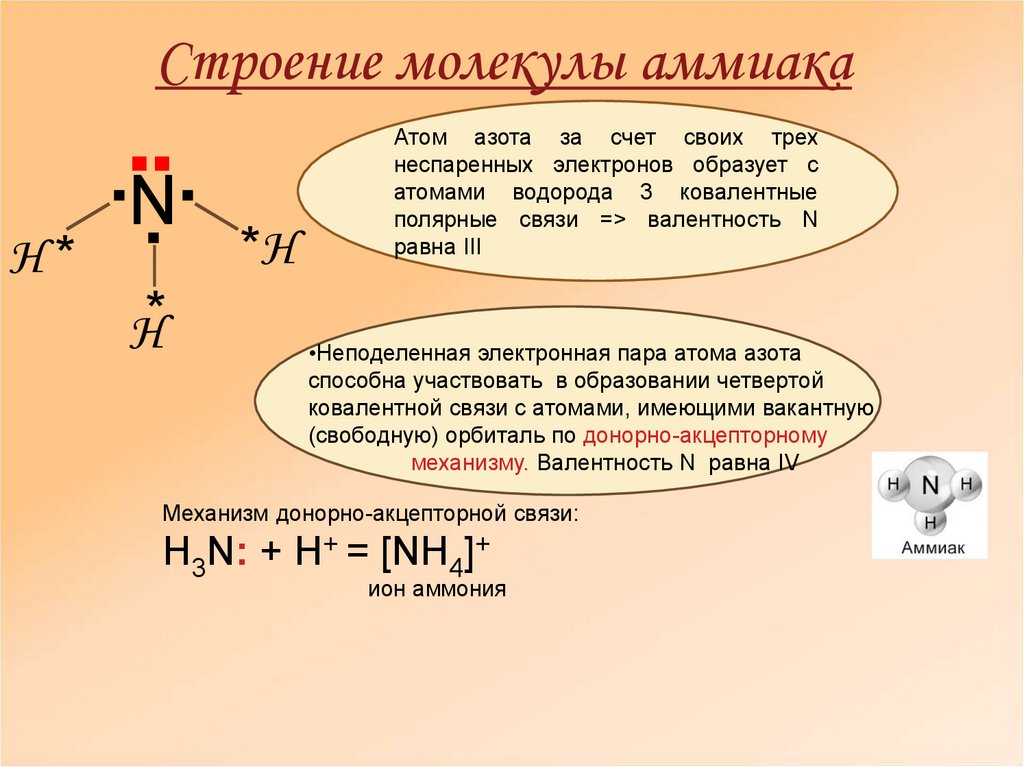 д. Поэтому мы измеряем здоровье природных водоемов, потому что аммиак может напрямую отравить нас при высоких концентрациях. Обозначим аммиачный азот как NH 3 -Н.
д. Поэтому мы измеряем здоровье природных водоемов, потому что аммиак может напрямую отравить нас при высоких концентрациях. Обозначим аммиачный азот как NH 3 -Н.
Рисунок 02: Круговорот азота показывает формы аммиачного азота в окружающей среде
Единицей измерения является мг/л. В этом измерении мы измеряем все формы аммиака; аммиак (NH 3 ), аммоний (NH 4 + ), газообразный азот (N 2 ), нитраты (NO 3 – ), нитриты (NO
2 904) органический азот, такой как белки, ДНК и т. д.
В чем разница между аммиаком и аммиачным азотом?
Аммиак представляет собой неорганическое соединение, имеющее химическую формулу Nh4. Он полезен при низких концентрациях и токсичен при высоких концентрациях. Аммиачный азот является мерой количества аммиака в образце. Он измеряет количество аммиака на его токсичном уровне. Кроме того, это относится ко всем формам аммиака, таким как аммиак (NH 3 ), аммоний (NH 4 + ), газообразный азот (N 2 ), нитраты (NO 3 – ), нитриты (NO 2 – ), органический азот, такой как белки, ДНК и т. д.
д.
Резюме – Аммиак в сравнении с аммиачным азотом
Аммиак и аммиачный азот – это два взаимосвязанных термина. Разница между аммиаком и аммиачным азотом заключается в том, что аммиак представляет собой неорганическое соединение, имеющее химическую формулу Nh4, тогда как аммиачный азот является мерой количества аммиака в образце.
Артикул:
1. «Аммиак». Национальный центр биотехнологической информации. База данных соединений PubChem, Национальная медицинская библиотека США. Доступно здесь
2. «Аммонийный азот». Википедия, Фонд Викимедиа, 10 июля 2018 г. Доступно здесь
Изображение предоставлено:
(CC BY-SA 3.0) через Commons Wikimedia
Аммиак и аммоний — в чем разница между этими формами азота?
Вы были перенаправлены на этот ответ на основании совпадения идентификатора.
кликните сюда
чтобы увидеть результаты поиска по этой фразе.
Вопрос
Аммиак и аммоний – в чем разница между этими формами азота?
Резюме
Сравнение аммиака и аммония
Ответ
Аммиак и аммоний — разные формы азота. Основным фактором, определяющим соотношение аммиака и аммония в воде, является рН. На активность аммиака также влияют ионная сила и температура. Важно помнить, что неионизированный NH 3 может быть вреден для водных организмов, тогда как ионизированный аммоний практически безвреден.
Основным фактором, определяющим соотношение аммиака и аммония в воде, является рН. На активность аммиака также влияют ионная сила и температура. Важно помнить, что неионизированный NH 3 может быть вреден для водных организмов, тогда как ионизированный аммоний практически безвреден.
Химическое уравнение, определяющее взаимосвязь между аммиаком и аммонием:
NH 3 + h3O <-> NH 4 + + OH —
вправо, а при высоком рН реакция идет влево. В общем, при температуре около комнатной температуры, при pH менее 6,0 доля аммоний-N плюс аммиак-N как NH 3 очень-очень низка, так и как NH 4 + очень-очень высокий. При pH около 8,0 пропорция NH 3 составляет 10 процентов или менее, а при pH чуть выше 9,0 пропорция составляет около 50 процентов. Активность водного аммиака также значительно ниже при низких температурах и выше при теплых температурах. Это означает, что при низких температурах и низком рН активность по типу NH 3 еще ниже, а по типу NH 4 + еще выше. Как только pH станет > 11, все ионы аммония-N в растворе будут преобразованы в аммиак-N.
Как только pH станет > 11, все ионы аммония-N в растворе будут преобразованы в аммиак-N.
IntelliCAL ISENh4181 ISE для аммиака можно использовать для измерения ионов аммония (NH 4 + ) после преобразования в аммиак (NH 3 ). Это делается путем добавления Hach Ammonia ISA, который буферизует pH до > 11 и увеличивает ионную силу образца. Метод ISE для аммиака измеряет аммоний-N плюс аммиак-N. Очень сложно непосредственно определить активность водного аммиака, поэтому вместо этого используется заменитель аммоний-N плюс аммиак-N, а затем используются табличные значения аммоний-N плюс аммиак-N, чтобы определить, обеспечит ли измеренная концентрация аммиак на уровне, губительном для водных организмов.
Если известны температура и pH образца, приведенную ниже таблицу можно использовать для определения процентного содержания общего аммиака в форме аммиака (NH 3 ). Этот процент в десятичной форме можно умножить на общее количество аммиака в образце, чтобы рассчитать форму аммиака NH 3 .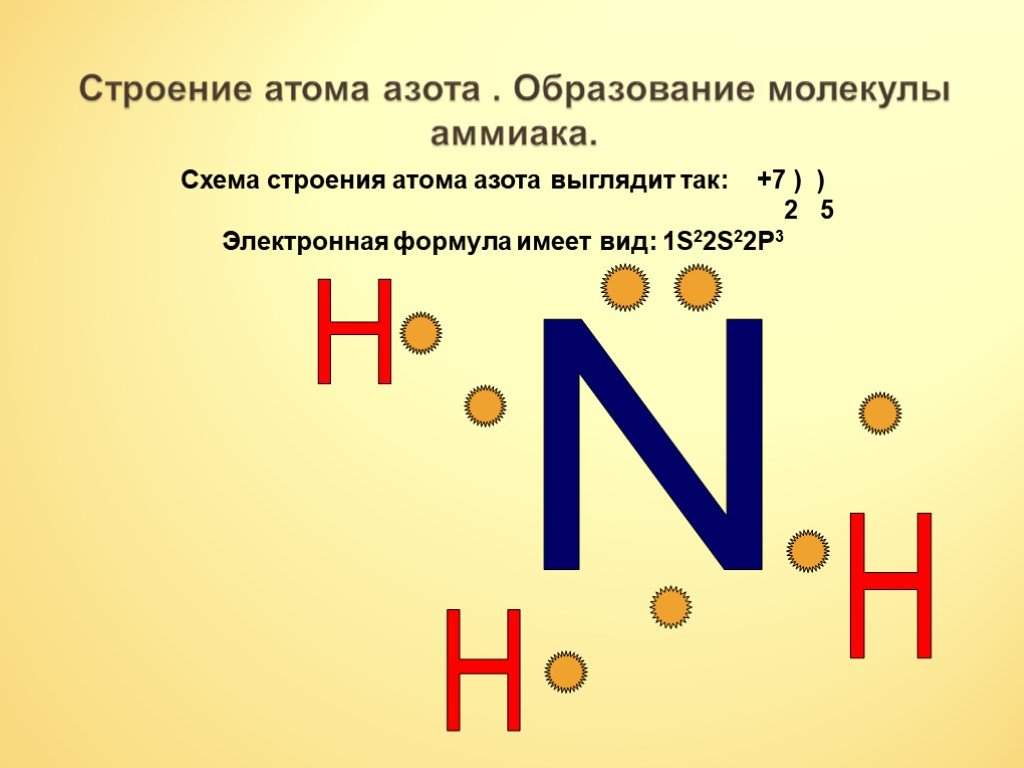

 И.Акулинин, О.О.Голубятников, С.И.Дворецкий. – Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №11. – С.8-29.- на английском языке (ключевые слова: азот, адсорбция, математическое моделирование, водород, кислород, проектирование).
И.Акулинин, О.О.Голубятников, С.И.Дворецкий. – Текст: непосредственный // Известия вузов. Химия и химическая технология. – 2021. — №11. – С.8-29.- на английском языке (ключевые слова: азот, адсорбция, математическое моделирование, водород, кислород, проектирование). Г.Горбовский, А.И.Казаков, А.М.Норов, А.И.Михайличенко. — Текст: непосредственный //Химическая технология. – 2021. — №6. – С.253-260. (ключевые слова: аммоний, нитрат аммония, микроэлементы, медь, комплексные удобрения).
Г.Горбовский, А.И.Казаков, А.М.Норов, А.И.Михайличенко. — Текст: непосредственный //Химическая технология. – 2021. — №6. – С.253-260. (ключевые слова: аммоний, нитрат аммония, микроэлементы, медь, комплексные удобрения). А. Сорбционное извлечение редкоземельных элементов на сульфокатионите КУ-2-8 из азотных растворов вскрытия лопаритового концентрата / Д.А.Елатонцев, А.П.Мухачев. — Текст: непосредственный //Химическая технология. – 2021. — №7. – С.312-317.(ключевые слова:азот, азотнокислый раствор, иониты, сорбция, редкоземельные элементы, химические исследования).
А. Сорбционное извлечение редкоземельных элементов на сульфокатионите КУ-2-8 из азотных растворов вскрытия лопаритового концентрата / Д.А.Елатонцев, А.П.Мухачев. — Текст: непосредственный //Химическая технология. – 2021. — №7. – С.312-317.(ключевые слова:азот, азотнокислый раствор, иониты, сорбция, редкоземельные элементы, химические исследования). Ф.Крысенко, Е.Э Дмитриева, Д.Г.Эпов [и др.]. — Текст: непосредственный //Химическая технология. – 2021. — №8. – С.338-344. (ключевые слова: аммоний, сульфат аммония, двойной сульфат аммония и кальция, двойной сульфат аммония и железа, выщелачивание).
Ф.Крысенко, Е.Э Дмитриева, Д.Г.Эпов [и др.]. — Текст: непосредственный //Химическая технология. – 2021. — №8. – С.338-344. (ключевые слова: аммоний, сульфат аммония, двойной сульфат аммония и кальция, двойной сульфат аммония и железа, выщелачивание). (ключевые слова: четвертичные аммониевые соли, сорбция, красители, полисахариды).
(ключевые слова: четвертичные аммониевые соли, сорбция, красители, полисахариды).