Содержание
Всасывание, распределение и выведение лекарственных средств — ЗдоровьеИнфо
Всасывание
Полнота и скорость всасывания лекарственного вещества определяют его биодоступность. Она характеризуется долей попадающего в кровь лекарства от общего его количества, введенного в организм. Биодоступность зависит от ряда факторов, включающих путь введения препарата, его физические и химические свойства, а также физиологические особенности принимающего его человека.
Единицей лекарственного средства является та или иная его форма, содержащая определенную дозу активного вещества — таблетка, капсула, свеча, пластырь или ампула. Активное вещество обычно объединено с другими компонентами. Например, таблетки — это смесь действующего средства и добавок, которые выполняют роль растворителей, стабилизаторов, размельчителей и формообразующих компонентов. Смесь гранулируют и прессуют в форму таблетки. Время, необходимое для ее растворения, зависит от вида и количества добавок, а также степени их спрессованности. Изготовители лекарственных препаратов подбирают эти параметры так, чтобы скорость и объем всасывания были оптимальными.
Изготовители лекарственных препаратов подбирают эти параметры так, чтобы скорость и объем всасывания были оптимальными.
Если таблетка растворяется и активное вещество высвобождается слишком быстро, его концентрация в крови может вызывать чрезмерную реакцию. С другой стороны, если растворение таблетки и высвобождение лекарственного средства происходит недостаточно быстро, большая его часть будет проходить по кишечнику и выводиться с каловыми массами, не попадая в кровь в нужном количестве. Понос или слабительные средства, ускоряющие прохождение пищевой массы через желудочно-кишечный тракт, уменьшают всасывание препарата. Таким образом, на биодоступность лекарственного средства влияют пища, другие лекарства и болезни желудочно-кишечного тракта.
Желательно, чтобы лекарства с одинаковым международным названием имели схожую биодоступность. Химически эквивалентные препараты содержат одно и то же активное действующее средство, но могут иметь различные неактивные компоненты, влияющие на скорость и объем всасывания. Действие препаратов, изготовленных разными фармацевтическими фирмами, нередко отличается даже при одинаковой дозе активного вещества. Лекарства биоэквивалентны, если они не только содержат один и тот же активный компонент, но и создают одинаковую его концентрацию в крови через определенное время. Биоэквивалентность гарантирует сходный лечебный эффект, поэтому биоэквивалентные препараты взаимозаменяемы.
Действие препаратов, изготовленных разными фармацевтическими фирмами, нередко отличается даже при одинаковой дозе активного вещества. Лекарства биоэквивалентны, если они не только содержат один и тот же активный компонент, но и создают одинаковую его концентрацию в крови через определенное время. Биоэквивалентность гарантирует сходный лечебный эффект, поэтому биоэквивалентные препараты взаимозаменяемы.
Некоторые лекарства изготовлены таким образом, чтобы их активные компоненты высвобождались в течение 12 часов или более. Существуют специальные лекарственные формы препаратов, которые обеспечивают медленное поступление действующего вещества в кровоток (препараты пролонгированного действия). Например, частицы лекарственного средства в капсуле покрыты слоями полимеров (химических веществ) разной толщины, подобранными с таким расчетом, чтобы полимеры растворялись в желудочно-кишечном тракте в разное время.
Некоторые таблетки и капсулы имеют защитное покрытие, предотвращающее повреждение слизистой оболочки желудка раздражающими веществами типа аспирина или разрушение активных компонентов в кислой среде желудка. Эти лекарственные формы покрыты материалом, который начинает растворяться только при контакте с менее кислой средой или с пищеварительными ферментами тонкой кишки. Однако такое покрытие не всегда растворяется полностью, и у многих людей, особенно пожилых, эти таблетки в неизмененном виде попадают в каловые массы.
Эти лекарственные формы покрыты материалом, который начинает растворяться только при контакте с менее кислой средой или с пищеварительными ферментами тонкой кишки. Однако такое покрытие не всегда растворяется полностью, и у многих людей, особенно пожилых, эти таблетки в неизмененном виде попадают в каловые массы.
На всасывание препарата после приема внутрь влияют и другие свойства твердых лекарственных форм (таблеток и капсул). Например, капсулы состоят из действующих веществ и добавок, окруженных желатиновой оболочкой. Намокая, желатин набухает и позволяет содержимому проникнуть наружу, а сама оболочка, как правило, быстро разрушается. Кроме того, на скорость всасывания влияет размер частиц активного вещества и неактивных компонентов. Лекарства всасываются быстрее из капсул с жидким, а не твердым содержимым.
Распределение
После того как лекарство попало в кровоток, оно быстро разносится по всему организму, поскольку кровь совершает полный круг по кровеносной системе в среднем за 1 минуту. Однако переход лекарственного средства из крови в ткани тела может происходить медленно. Лекарство поступает в различные ткани с неодинаковой скоростью в зависимости от его способности проникать через мембраны клеток. Например, средство для наркоза тиопентал быстро попадает в мозг, а антибиотик пенициллин — медленно. Как правило, жирорастворимые препараты проходят через мембраны клеток легче, чем водорастворимые.
Однако переход лекарственного средства из крови в ткани тела может происходить медленно. Лекарство поступает в различные ткани с неодинаковой скоростью в зависимости от его способности проникать через мембраны клеток. Например, средство для наркоза тиопентал быстро попадает в мозг, а антибиотик пенициллин — медленно. Как правило, жирорастворимые препараты проходят через мембраны клеток легче, чем водорастворимые.
Большинство лекарственных средств после всасывания распределяются в организме неравномерно. Одни из них задерживаются в крови или мышцах, а другие скапливаются в определенных органах — щитовидной железе, печени или почках. Существуют лекарства, которые прочно связываются с белками крови и покидают кровоток очень медленно, в то время как многие средства быстро переходят из крови в другие ткани. Иногда в каком-то месте создается такая высокая концентрация препарата, что оно превращается в его «депо» в организме, таким образом увеличивая продолжительность терапевтического эффекта. Некоторые лекарства циркулируют в крови в течение нескольких дней после прекращения их приема, поскольку они продолжают постепенно высвобождаться из ткани, где произошло их накопление.
Некоторые лекарства циркулируют в крови в течение нескольких дней после прекращения их приема, поскольку они продолжают постепенно высвобождаться из ткани, где произошло их накопление.
Кроме того, распределение лекарственных средств зависит от индивидуальных особенностей больного. Например, людям крупного телосложения, имеющим больший объем тканей и циркулирующей крови, требуется большее количество препарата. В организме человека, страдающего ожирением, может задерживаться значительное количество лекарств, которые откладываются в жировой ткани, в то время как у худощавых людей таких «возможностей» относительно немного. Накопление лекарственных средств в жировой ткани также замечено у пожилых людей, потому что доля жировой ткани в организме с возрастом увеличивается.
Выведение
Лекарства либо подвергаются метаболизму (видоизменяются) в организме, либо выводятся в неизмененном виде. Метаболизм — это процесс, в ходе которого происходит химическое изменение лекарственных средств. В основном он протекает в печени. Продукты метаболизма (метаболиты) могут быть неактивны, а могут иметь похожую или отличающуюся от исходного препарата активность и токсичность. Некоторые лекарства (пролекарства) применяют в неактивной форме, а активными они становятся и вызывают желаемые эффекты после соответствующего превращения. Эти активные метаболиты выводятся в неизмененной форме (главным образом с мочой или калом) или подвергаются дальнейшим преобразованиям и в конечном счете также выводятся из организма.
В основном он протекает в печени. Продукты метаболизма (метаболиты) могут быть неактивны, а могут иметь похожую или отличающуюся от исходного препарата активность и токсичность. Некоторые лекарства (пролекарства) применяют в неактивной форме, а активными они становятся и вызывают желаемые эффекты после соответствующего превращения. Эти активные метаболиты выводятся в неизмененной форме (главным образом с мочой или калом) или подвергаются дальнейшим преобразованиям и в конечном счете также выводятся из организма.
Печень содержит ферменты, благодаря которым происходят химические реакции окисления, расщепления и гидролиза лекарств, а также ферменты, присоединяющие к лекарству другие вещества в ходе реакции конъюгации. Конъюгаты (молекулы лекарственного средства с присоединенными веществами) выводятся с мочой.
У новорожденных метаболические ферментные системы развиты только частично, поэтому метаболизм многих лекарств у младенцев затруднен и, следовательно, им требуется меньшее количество лекарственного средства на единицу веса тела, чем взрослым. В то же время дети от 2 до 12 лет нуждаются в большем количестве лекарств. Подобно новорожденным, у пожилых людей тоже уменьшена ферментативная активность, и они не способны видоизменять (метаболизировать) лекарства, как молодые люди. В итоге новорожденные и пожилые люди, как правило, нуждаются в меньших, а подростки в больших дозах лекарственных средств на единицу веса тела.
В то же время дети от 2 до 12 лет нуждаются в большем количестве лекарств. Подобно новорожденным, у пожилых людей тоже уменьшена ферментативная активность, и они не способны видоизменять (метаболизировать) лекарства, как молодые люди. В итоге новорожденные и пожилые люди, как правило, нуждаются в меньших, а подростки в больших дозах лекарственных средств на единицу веса тела.
Термин выделение (экскреция) обозначает процессы, с помощью которых организм освобождается от лекарства. Главными органами выделения являются почки. Они особенно важны для удаления водорастворимых препаратов и их метаболитов.
Почки фильтруют лекарство из крови и выводят с мочой. На их выделительную способность оказывают влияние многие факторы, например состояние почек и скорость кровотока через них, существование нарушений, препятствующих оттоку мочи. Кроме того, лекарственные средства или их метаболиты должны быть растворимы в воде и не слишком сильно связаны с белками плазмы крови. Скорость, с которой выделяются некоторые лекарства, имеющие кислотные или основные (щелочные) свойства, зависит от кислотности мочи.
По мере старения человека функциональные возможности почек уменьшаются. При выделении лекарств почка 85-летнего человека работает приблизительно в половину мощности по сравнению с почкой 35-летнего. Множество болезней, особенно высокое артериальное давление, сахарный диабет и хронические почечные инфекции, а также воздействие больших количеств токсических веществ, могут ухудшать способность почек выводить лекарства.
Если работа почек нарушена, врач скорректирует дозу лекарства, выведение которого осуществляется прежде всего через эти органы, учитывая естественный процесс снижения функции почек с возрастом. Однако более точный способ рассчитать нужную дозу состоит в том, чтобы оценить функции почек с помощью специального анализа крови (измерение количества креатинина в ее сыворотке), иногда в сочетании с анализом мочи (измерение количества креатинина в моче, собранной за 12–24 часа).
Некоторые лекарства удаляются из организма с желчью благодаря работе печени. Они поступают в желудочно-кишечный тракт и либо выводятся с калом, либо повторно всасываются из кишечника и поступают в кровоток, либо разрушаются. Существуют препараты, которые в небольшом количестве выводятся со слюной, потом, грудным молоком и даже выдыхаемым воздухом. Для человека, страдающего болезнью печени, необходимо скорректировать дозу лекарственного средства, выделяемого в основном через этот орган. Но простых способов оценить функцию печени, связанную с метаболизмом лекарств, подобно тем, что используют для оценки функции почек, не существует.
Существуют препараты, которые в небольшом количестве выводятся со слюной, потом, грудным молоком и даже выдыхаемым воздухом. Для человека, страдающего болезнью печени, необходимо скорректировать дозу лекарственного средства, выделяемого в основном через этот орган. Но простых способов оценить функцию печени, связанную с метаболизмом лекарств, подобно тем, что используют для оценки функции почек, не существует.
Фармакология, под. ред. Ю. Ф. Крылова и В. М. Бобырева.
Назад
Оглавление
Вперёд
Выведение неизмененного лекарственного вещества или его метаболитов осуществляется всеми экскреторными органами (почками, кишечником, легкими, молочными, слюнными, потовыми железами и др.).
Основным органом выведения лекарств из организма являются почки. Выведение лекарств почками происходит путем фильтрации и с помощью активного или пассивного транспорта. Липоидорастворимые вещества легко фильтруются в клубочках, но в канальцах они вновь пассивно всасываются. Препараты, слабо растворимые в липоидах, быстрее выводятся с мочой, поскольку они плохо реабсорбируются в почечных канальцах. Кислая реакция мочи способствует выведению щелочных соединений и затрудняет экскрецию кислых. Поэтому при интоксикации лекарствами кислого характера (например, барбитуратами) применяют натрия гидрокарбонат или другие щелочные соединения, а при интоксикации алкалоидами, имеющими щелочной характер, используют аммония хлорид. Ускорить выведение лекарств из организма можно и назначением сильнодействующих мочегонных средств, например, осмотических диуретиков или фуросемида, на фоне введения в организм большого количества жидкости (форсированный диурез). Выведение из организма оснований и кислот происходит путем активного транспорта. Этот процесс идет с затратой энергии и с помощью определенных ферментных систем-переносчиков. Создавая конкуренцию за переносчик каким-либо веществом, можно замедлить выведение лекарства (например, этамид и пенициллин секретируются с помощью одних и тех же ферментных систем, поэтому этамид замедляет выведение пенициллина).
Препараты, слабо растворимые в липоидах, быстрее выводятся с мочой, поскольку они плохо реабсорбируются в почечных канальцах. Кислая реакция мочи способствует выведению щелочных соединений и затрудняет экскрецию кислых. Поэтому при интоксикации лекарствами кислого характера (например, барбитуратами) применяют натрия гидрокарбонат или другие щелочные соединения, а при интоксикации алкалоидами, имеющими щелочной характер, используют аммония хлорид. Ускорить выведение лекарств из организма можно и назначением сильнодействующих мочегонных средств, например, осмотических диуретиков или фуросемида, на фоне введения в организм большого количества жидкости (форсированный диурез). Выведение из организма оснований и кислот происходит путем активного транспорта. Этот процесс идет с затратой энергии и с помощью определенных ферментных систем-переносчиков. Создавая конкуренцию за переносчик каким-либо веществом, можно замедлить выведение лекарства (например, этамид и пенициллин секретируются с помощью одних и тех же ферментных систем, поэтому этамид замедляет выведение пенициллина).
Препараты, плохо всасывающиеся из желудочно-кишечного тракта, выводятся кишечником и применяются при гастритах, энтеритах и колитах (например, вяжущие средства, некоторые антибиотики используемые при кишечных инфекциях). Кроме того, из печеночных клеток лекарства и их метаболиты попадают в желчь и с нею поступают в кишечник, откуда либо повторно всасываются, доставляются в печень, а затем с желчью в кишечник (кишечно- печеночная циркуляция), либо выводятся из организма с каловыми массами. Не исключается и прямая секреция ряда лекарств и их метаболитов стенкой кишечника.
Через легкие выводятся летучие вещества и газы (эфир, закись азота, камфора и т.д.). Для ускорения их выброса необходимо увеличить объем легочной вентиляции.
Многие лекарственные препараты могут экскретироваться с молоком, особенно слабые основания и неэлектролиты, что следует учитывать при лечении кормящих матерей.
Некоторые лекарственные вещества частично выводятся железами слизистой оболочки полости рта, оказывая местное (например, раздражающее) действие на путях выведения. Так, тяжелые металлы (ртуть, свинец, железо, висмут), выделяясь слюнными железами, вызывают раздражение слизистой оболочки полости рта, возникают стоматиты и гингивиты. Кроме того, они вызывают появление темной каймы по десневому краю, особенно в области кариозных зубов, что обусловлено взаимодействием тяжелых металлов с сероводородом в полости рта и образованием практически нерастворимых сульфидов. Такая «кайма» является диагностическим признаком хронического отравления тяжелыми металлами.
Так, тяжелые металлы (ртуть, свинец, железо, висмут), выделяясь слюнными железами, вызывают раздражение слизистой оболочки полости рта, возникают стоматиты и гингивиты. Кроме того, они вызывают появление темной каймы по десневому краю, особенно в области кариозных зубов, что обусловлено взаимодействием тяжелых металлов с сероводородом в полости рта и образованием практически нерастворимых сульфидов. Такая «кайма» является диагностическим признаком хронического отравления тяжелыми металлами.
При длительном применении дифенина и вальпроата натрия (противосудорожные препараты) раздражение слизистой оболочки десны может быть причиной возникновения гипертрофического гингивита («дифениновый гингивит»).
Ликвидация наркотиков — StatPearls — Книжная полка NCBI
Аарон З. Гарза; Шэрон Б. Парк; Ремек Коч.
Информация об авторе
Последнее обновление: 11 июля 2022 г.
Определение/Введение
Выведение лекарства — это сумма процессов выведения введенного лекарства из организма. В фармакокинетической схеме ADME (всасывание, распределение, метаболизм и экскреция) часто считается, что она охватывает как метаболизм, так и экскрецию. Гидрофобные препараты, чтобы быть выведенными, должны пройти метаболическую модификацию, сделав их более полярными. С другой стороны, гидрофильные препараты могут выводиться напрямую, без необходимости метаболических изменений в их молекулярных структурах.
В фармакокинетической схеме ADME (всасывание, распределение, метаболизм и экскреция) часто считается, что она охватывает как метаболизм, так и экскрецию. Гидрофобные препараты, чтобы быть выведенными, должны пройти метаболическую модификацию, сделав их более полярными. С другой стороны, гидрофильные препараты могут выводиться напрямую, без необходимости метаболических изменений в их молекулярных структурах.
Несмотря на то, что существует много мест метаболизма и выделения, главным органом метаболизма является печень, а органом, главным образом отвечающим за выделение, являются почки. Любая значительная дисфункция любого органа может привести к накоплению препарата или его метаболитов в токсических концентрациях.
На элиминацию влияет множество других факторов — внутренние свойства лекарства, такие как полярность, размер или pKa. Также к другим факторам относятся генетические различия между людьми, болезненные состояния, поражающие другие органы, и пути, участвующие в распределении лекарства по организму, такие как метаболизм первого прохождения.
Вопросы, вызывающие озабоченность
Выведение лекарства — это удаление введенного лекарства из организма. Это достигается двумя путями: либо экскрецией неметаболизированного лекарственного средства в его интактной форме, либо метаболической биотрансформацией с последующей экскрецией. Хотя выведение в основном осуществляется почками, участвуют и другие системы органов. Точно так же печень является основным местом биотрансформации, однако внепеченочный метаболизм происходит в различных системах органов, влияющих на многие лекарства.
При наличии нескольких систем органов и разнообразии метаболических преобразований выведение лекарств может быть сопряжено со значительной степенью сложности. Гидрофильные препараты обычно выводятся непосредственно почками, в то время как гидрофобные препараты перед выведением подвергаются биотрансформации. Цель здесь двоякая – биотрансформация служит как для детоксикации экзогенных веществ, так и для повышения их гидрофильности, обеспечивая их выведение через почки.
Существует два широких метаболических пути трансформации лекарств в печени. Фаза I представляет собой прямую модификацию молекулы-мишени, тогда как фаза II влечет за собой конъюгацию мишени с полярной молекулой низкой молекулярной массы. Фаза I подготавливает лекарство к переходу в фазу II, но также существует однофазный метаболизм.[1][2]
Фаза I включает окисление, восстановление и гидролиз экзогенной молекулы. Эти реакции осуществляются печеночными микросомальными ферментами, которые находятся в гладком эндоплазматическом ретикулуме гепатоцитов. Наиболее известна среди них система цитохрома Р450, ферменты которой преимущественно участвуют в окислительном метаболизме. В семействе цитохромов Р450 (CYP) ферментом, ответственным за метаболизм более 50% существующих лекарств, является CYP3A4. Его активность распространяется на различные классы лекарств, включая опиоиды, иммунодепрессанты, антигистаминные препараты и бензодиазепины. Ферменты также могут индуцироваться или ингибироваться различными веществами, с которыми они взаимодействуют, включая фармацевтические препараты. Увеличение метаболической активности при индукции CYP приводит к снижению активности лекарств, на которые нацелена эта конкретная изоформа. И наоборот, ингибирование CYP приведет к увеличению концентрации препарата в плазме, что может привести к токсичности. CYP3A4 индуцируется фенитоином, фенобарбиталом и зверобоем, а дилтиазем, эритромицин и грейпфрут ингибируют его. Поэтому необходима осторожность при введении препаратов, метаболизирующихся CYP3A4, в присутствии любого из ингибиторов или индукторов.[3][4]
Увеличение метаболической активности при индукции CYP приводит к снижению активности лекарств, на которые нацелена эта конкретная изоформа. И наоборот, ингибирование CYP приведет к увеличению концентрации препарата в плазме, что может привести к токсичности. CYP3A4 индуцируется фенитоином, фенобарбиталом и зверобоем, а дилтиазем, эритромицин и грейпфрут ингибируют его. Поэтому необходима осторожность при введении препаратов, метаболизирующихся CYP3A4, в присутствии любого из ингибиторов или индукторов.[3][4]
Фаза II состоит из ковалентного связывания полярных групп с неполярными молекулами, что делает их водорастворимыми и обеспечивает выведение почками или желчью. Молекулы-мишени входят в фазу II напрямую или через первоначальный процессинг через фазу I. Переносятся различные полярные добавки, включая аминокислоты, глюкуроновую кислоту, глутатион, ацетат и сульфат. Глюкуронирование является одним из основных путей биотрансформации фазы II. Эту активность выполняет семейство ферментов UDP-глюкуронозилтрансферазы (UGT). Как правило, производные глюкуронида обладают меньшей активностью исходного лекарственного средства или вообще не обладают ею, но в некоторых случаях в результате образуются фармакологически активные соединения. Морфин-6-глюкуронид представляет собой метаболит морфина фазы II со значительной анальгетической активностью. Как и в случае с ферментами CYP, индукторами и ингибиторами фазы II, существуют ферменты, которые могут влиять на эффективность лекарств, которые полагаются на конъюгацию перед экскрецией.
Как правило, производные глюкуронида обладают меньшей активностью исходного лекарственного средства или вообще не обладают ею, но в некоторых случаях в результате образуются фармакологически активные соединения. Морфин-6-глюкуронид представляет собой метаболит морфина фазы II со значительной анальгетической активностью. Как и в случае с ферментами CYP, индукторами и ингибиторами фазы II, существуют ферменты, которые могут влиять на эффективность лекарств, которые полагаются на конъюгацию перед экскрецией.
Эффект первого прохождения – это особенность печеночного метаболизма, которая также играет роль в элиминации многих лекарств. Здесь энтерально потребляемые лекарственные средства попадают непосредственно в печень через воротную вену, где подвергаются биотрансформации перед попаданием в системный кровоток. Эта активность снижает биодоступность и должна учитываться в дозе, вводимой пациенту. Препараты, вводимые внутривенно, не подвержены эффекту первого прохождения.
Внепеченочный метаболизм препарата происходит в желудочно-кишечном тракте, почках, легких, плазме и коже.
Почечная экскреция завершает процесс выведения, который начинается в печени. Полярные препараты или их метаболиты фильтруются в почках и обычно не подвергаются реабсорбции.[5] Впоследствии они выводятся с мочой. рН мочи оказывает значительное влияние на экскрецию, так как ионизация препарата изменяется в зависимости от щелочной или кислой среды. Повышенная экскреция происходит со слабокислотными препаратами в щелочной моче и слабоосновными лекарствами в кислой моче.
Экскреция с желчью – еще одна важная форма выведения лекарственного средства. Печень может активно секретировать ионизированные препараты с молекулярной массой более 300 г/моль в желчь, откуда они попадают в пищеварительный тракт и либо выводятся с калом, либо реабсорбируются в рамках энтерогепатического цикла.
Другие пути выделения включают легкие, грудное молоко, пот, слюну и слезы.[6][7][8][9]
Клиническое значение
Заболевания печени, такие как цирроз печени, влияют на выведение лекарств через печень. Нарушение метаболических путей фазы I и II может привести к увеличению периода полувыведения препаратов длительного действия, что способствует токсичности. Снижение уровня белка плазмы при заболевании печени может привести к увеличению несвязанной фракции лекарственного средства в плазме. По мере того, как болезнь печени усугубляется, доза препарата должна быть уменьшена для получения того же эффекта. Изменения перфузии печени также могут влиять на метаболизм лекарственных средств. Состояния сниженного притока крови к печени, такие как шок, гиповолемия или гипотензия, могут привести к снижению скорости метаболизма.
Нарушение метаболических путей фазы I и II может привести к увеличению периода полувыведения препаратов длительного действия, что способствует токсичности. Снижение уровня белка плазмы при заболевании печени может привести к увеличению несвязанной фракции лекарственного средства в плазме. По мере того, как болезнь печени усугубляется, доза препарата должна быть уменьшена для получения того же эффекта. Изменения перфузии печени также могут влиять на метаболизм лекарственных средств. Состояния сниженного притока крови к печени, такие как шок, гиповолемия или гипотензия, могут привести к снижению скорости метаболизма.
Заболевания почек, такие как хроническое заболевание почек, могут снижать функцию почек, препятствуя выведению лекарственного средства. Поскольку функция почек ухудшается с возрастом, выведение препарата становится менее эффективным, и может потребоваться коррекция дозы. Помимо непосредственной почечной дисфункции, патологии, влияющие на почечный кровоток или мочеиспускание, также могут влиять на элиминацию лекарств. Примерами таких нарушений являются застойная сердечная недостаточность, заболевания печени и патологии, влияющие на выброс антидиуретического гормона.[10]
Примерами таких нарушений являются застойная сердечная недостаточность, заболевания печени и патологии, влияющие на выброс антидиуретического гормона.[10]
Сестринское дело, смежное здравоохранение и межпрофессиональные групповые вмешательства
У стареющих пациентов наблюдается снижение функции печени и почек. Критерии Берса были разработаны для стратификации риска у пожилых людей и полезны при дозировании лекарств у лиц старше 65 лет. Точно так же при назначении лекарств пациентам с заболеваниями печени или почек или с патологиями, которые могут повлиять на эти органы, необходимо учитывать корректировку дозы. На всех вкладышах к лекарственным препаратам от производителя обсуждаются конкретные проблемы, связанные с дозированием почечных и печеночных препаратов, о которых необходимо знать медицинским работникам для своих пациентов. [11]
Сестринское дело, смежные службы здравоохранения и мониторинг межпрофессиональных групп
При уходе за пациентами с заболеваниями печени или почек или состояниями, поражающими эти органы, медсестры должны учитывать тот факт, что это может повлиять на выведение лекарств. Дозы препаратов могут потребовать уменьшения (и/или частоты приема), а некоторые препараты могут потребовать отмены. Если введение конкретного препарата абсолютно необходимо, необходимо тщательное наблюдение за побочными эффектами. У пациентов, не страдающих патологией печени или почек, концентрацию в плазме таких препаратов, как ванкомицин или фенитоин, по-прежнему необходимо контролировать, чтобы убедиться, что они остаются в пределах терапевтического диапазона.[12]
Дозы препаратов могут потребовать уменьшения (и/или частоты приема), а некоторые препараты могут потребовать отмены. Если введение конкретного препарата абсолютно необходимо, необходимо тщательное наблюдение за побочными эффектами. У пациентов, не страдающих патологией печени или почек, концентрацию в плазме таких препаратов, как ванкомицин или фенитоин, по-прежнему необходимо контролировать, чтобы убедиться, что они остаются в пределах терапевтического диапазона.[12]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Алмазроо О.А., Миах М.К., Венкатараманан Р. Метаболизм лекарств в печени. Клин печени Dis. 2017 Февраль;21(1):1-20. [PubMed: 27842765]
- 2.
Corsini A, Bortolini M. Медикаментозное поражение печени: роль метаболизма и транспорта лекарств. Дж. Клин Фармакол. 2013 май; 53(5):463-74.
 [В паблике: 23436293]
[В паблике: 23436293]- 3.
Bernhardt R. Цитохромы Р450 как универсальные биокатализаторы. Дж Биотехнолог. 2006 25 июня; 124 (1): 128-45. [PubMed: 16516322]
- 4.
Zeng M, Yang L, He D, Li Y, Shi M, Zhang J. Метаболические пути и фармакокинетика натуральных лекарств с низкой проницаемостью. Drug Metab Rev. 2017 Nov; 49(4):464-476. [PubMed: 28911247]
- 5.
Leeson PD. Молекулярная инфляция, истощение и правило пяти. Adv Drug Deliv Rev. 2016 01 июня; 101: 22-33. [В паблике: 26836397]
- 6.
Комитет по наркотикам Американской академии педиатрии. Попадание лекарств и других химических веществ в грудное молоко. Педиатрия. 2001 г., сен; 108 (3): 776-89. [PubMed: 11533352]
- 7.
Johnson HL, Maibach HI. Экскреция препарата с эккринным потом человека. Джей Инвест Дерматол. 1971 март; 56 (3): 182-8. [PubMed: 5556511]
- 8.
Идкайдек Н.
 М. Сравнительная оценка слюны и плазмы для исследований биодоступности и биоэквивалентности лекарств у человека. Saudi Pharm J. 2017 июль; 25 (5): 671-675. [Бесплатная статья PMC: PMC5506617] [PubMed: 28725138]
М. Сравнительная оценка слюны и плазмы для исследований биодоступности и биоэквивалентности лекарств у человека. Saudi Pharm J. 2017 июль; 25 (5): 671-675. [Бесплатная статья PMC: PMC5506617] [PubMed: 28725138]- 9.
Стоу К.М., Плаа Г.Л. Внепочечное выведение лекарственных средств и химических веществ. Анну Рев Фармакол. 1968; 8: 337–356. [PubMed: 4875395]
- 10.
Асконапе Дж. Дж. Применение противоэпилептических препаратов при заболеваниях печени и почек. Handb Clin Neurol. 2014;119:417-32. [PubMed: 24365310]
- 11.
Американское гериатрическое общество, 2015 г. Экспертная группа по обновлению критериев Бирса. Американское общество гериатрии, 2015 г. Обновлены критерии Бирса для потенциально ненадлежащего использования лекарств у пожилых людей. J Am Geriatr Soc. 2015 ноябрь;63(11):2227-46. [В паблике: 26446832]
- 12.
Бринкманн А., Рёр А.С., Кёберер А., Фукс Т., Прейзенбергер Дж.
 , Крюгер В.А., Фрей ОР. Лекарственный мониторинг и индивидуальное дозирование антибиотиков при сепсисе: современно или просто «модно»? Мед Клин Интенсивмед Нотфмед. 2018 март; 113(2):82-93. [PubMed: 27624768]
, Крюгер В.А., Фрей ОР. Лекарственный мониторинг и индивидуальное дозирование антибиотиков при сепсисе: современно или просто «модно»? Мед Клин Интенсивмед Нотфмед. 2018 март; 113(2):82-93. [PubMed: 27624768]
Ликвидация наркотиков — StatPearls — Книжная полка NCBI
Аарон З. Гарза; Шэрон Б. Парк; Ремек Коч.
Информация об авторе
Последнее обновление: 11 июля 2022 г.
Определение/Введение
Выведение лекарства представляет собой сумму процессов выведения введенного лекарства из организма. В фармакокинетической схеме ADME (всасывание, распределение, метаболизм и экскреция) часто считается, что она охватывает как метаболизм, так и экскрецию. Гидрофобные препараты, чтобы быть выведенными, должны пройти метаболическую модификацию, сделав их более полярными. С другой стороны, гидрофильные препараты могут выводиться напрямую, без необходимости метаболических изменений в их молекулярных структурах.
Несмотря на то, что существует много мест метаболизма и выделения, главным органом метаболизма является печень, а органом, главным образом отвечающим за выделение, являются почки. Любая значительная дисфункция любого органа может привести к накоплению препарата или его метаболитов в токсических концентрациях.
Любая значительная дисфункция любого органа может привести к накоплению препарата или его метаболитов в токсических концентрациях.
На элиминацию влияет множество других факторов — внутренние свойства лекарства, такие как полярность, размер или pKa. Также к другим факторам относятся генетические различия между людьми, болезненные состояния, поражающие другие органы, и пути, участвующие в распределении лекарства по организму, такие как метаболизм первого прохождения.
Вопросы, вызывающие озабоченность
Выведение лекарства — это удаление введенного лекарства из организма. Это достигается двумя путями: либо экскрецией неметаболизированного лекарственного средства в его интактной форме, либо метаболической биотрансформацией с последующей экскрецией. Хотя выведение в основном осуществляется почками, участвуют и другие системы органов. Точно так же печень является основным местом биотрансформации, однако внепеченочный метаболизм происходит в различных системах органов, влияющих на многие лекарства.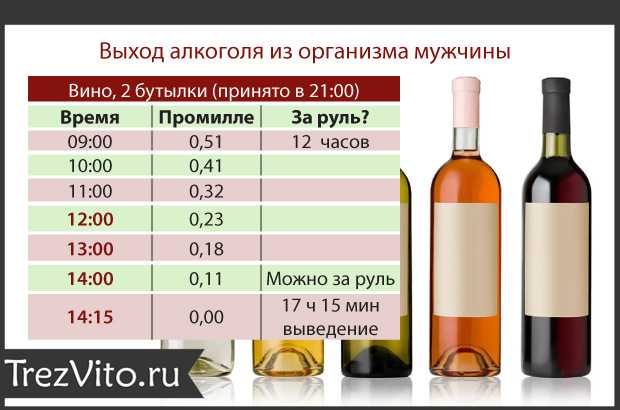
При наличии нескольких систем органов и разнообразии метаболических преобразований выведение лекарств может быть сопряжено со значительной степенью сложности. Гидрофильные препараты обычно выводятся непосредственно почками, в то время как гидрофобные препараты перед выведением подвергаются биотрансформации. Цель здесь двоякая – биотрансформация служит как для детоксикации экзогенных веществ, так и для повышения их гидрофильности, обеспечивая их выведение через почки.
Существует два широких метаболических пути трансформации лекарств в печени. Фаза I представляет собой прямую модификацию молекулы-мишени, тогда как фаза II влечет за собой конъюгацию мишени с полярной молекулой низкой молекулярной массы. Фаза I подготавливает лекарство к переходу в фазу II, но также существует однофазный метаболизм.[1][2]
Фаза I включает окисление, восстановление и гидролиз экзогенной молекулы. Эти реакции осуществляются печеночными микросомальными ферментами, которые находятся в гладком эндоплазматическом ретикулуме гепатоцитов.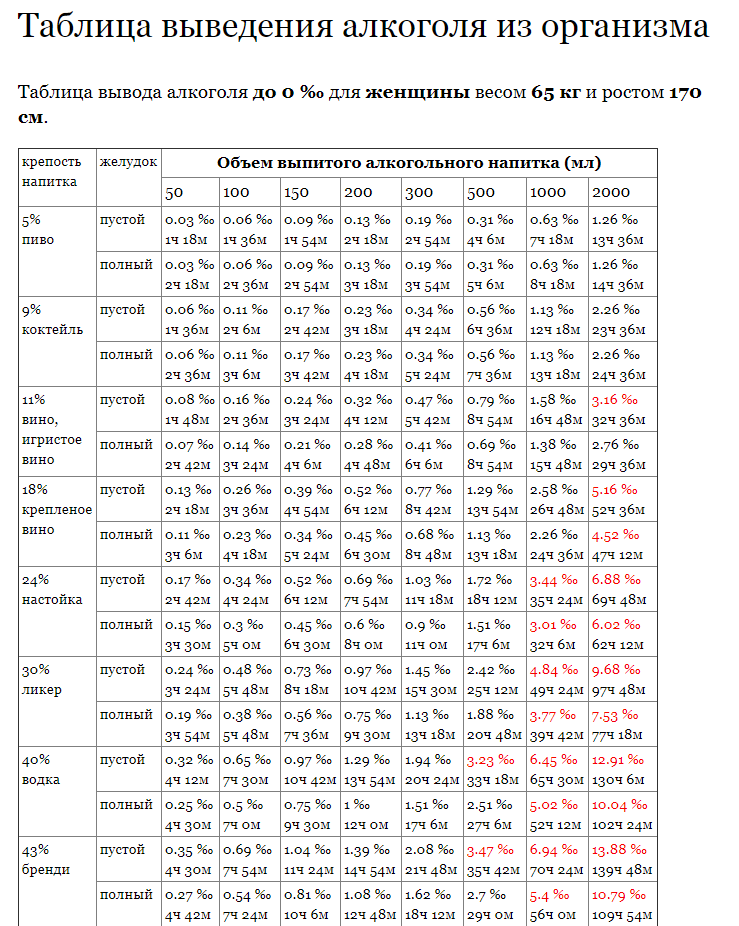 Наиболее известна среди них система цитохрома Р450, ферменты которой преимущественно участвуют в окислительном метаболизме. В семействе цитохромов Р450 (CYP) ферментом, ответственным за метаболизм более 50% существующих лекарств, является CYP3A4. Его активность распространяется на различные классы лекарств, включая опиоиды, иммунодепрессанты, антигистаминные препараты и бензодиазепины. Ферменты также могут индуцироваться или ингибироваться различными веществами, с которыми они взаимодействуют, включая фармацевтические препараты. Увеличение метаболической активности при индукции CYP приводит к снижению активности лекарств, на которые нацелена эта конкретная изоформа. И наоборот, ингибирование CYP приведет к увеличению концентрации препарата в плазме, что может привести к токсичности. CYP3A4 индуцируется фенитоином, фенобарбиталом и зверобоем, а дилтиазем, эритромицин и грейпфрут ингибируют его. Поэтому необходима осторожность при введении препаратов, метаболизирующихся CYP3A4, в присутствии любого из ингибиторов или индукторов.
Наиболее известна среди них система цитохрома Р450, ферменты которой преимущественно участвуют в окислительном метаболизме. В семействе цитохромов Р450 (CYP) ферментом, ответственным за метаболизм более 50% существующих лекарств, является CYP3A4. Его активность распространяется на различные классы лекарств, включая опиоиды, иммунодепрессанты, антигистаминные препараты и бензодиазепины. Ферменты также могут индуцироваться или ингибироваться различными веществами, с которыми они взаимодействуют, включая фармацевтические препараты. Увеличение метаболической активности при индукции CYP приводит к снижению активности лекарств, на которые нацелена эта конкретная изоформа. И наоборот, ингибирование CYP приведет к увеличению концентрации препарата в плазме, что может привести к токсичности. CYP3A4 индуцируется фенитоином, фенобарбиталом и зверобоем, а дилтиазем, эритромицин и грейпфрут ингибируют его. Поэтому необходима осторожность при введении препаратов, метаболизирующихся CYP3A4, в присутствии любого из ингибиторов или индукторов.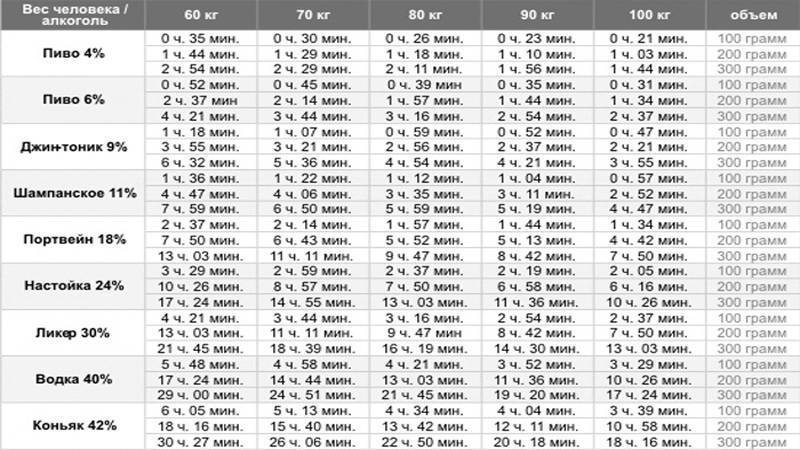 [3][4]
[3][4]
Фаза II состоит из ковалентного связывания полярных групп с неполярными молекулами, что делает их водорастворимыми и обеспечивает выведение почками или желчью. Молекулы-мишени входят в фазу II напрямую или через первоначальный процессинг через фазу I. Переносятся различные полярные добавки, включая аминокислоты, глюкуроновую кислоту, глутатион, ацетат и сульфат. Глюкуронирование является одним из основных путей биотрансформации фазы II. Эту активность выполняет семейство ферментов UDP-глюкуронозилтрансферазы (UGT). Как правило, производные глюкуронида обладают меньшей активностью исходного лекарственного средства или вообще не обладают ею, но в некоторых случаях в результате образуются фармакологически активные соединения. Морфин-6-глюкуронид представляет собой метаболит морфина фазы II со значительной анальгетической активностью. Как и в случае с ферментами CYP, индукторами и ингибиторами фазы II, существуют ферменты, которые могут влиять на эффективность лекарств, которые полагаются на конъюгацию перед экскрецией.
Эффект первого прохождения – это особенность печеночного метаболизма, которая также играет роль в элиминации многих лекарств. Здесь энтерально потребляемые лекарственные средства попадают непосредственно в печень через воротную вену, где подвергаются биотрансформации перед попаданием в системный кровоток. Эта активность снижает биодоступность и должна учитываться в дозе, вводимой пациенту. Препараты, вводимые внутривенно, не подвержены эффекту первого прохождения.
Внепеченочный метаболизм препарата происходит в желудочно-кишечном тракте, почках, легких, плазме и коже.
Почечная экскреция завершает процесс выведения, который начинается в печени. Полярные препараты или их метаболиты фильтруются в почках и обычно не подвергаются реабсорбции.[5] Впоследствии они выводятся с мочой. рН мочи оказывает значительное влияние на экскрецию, так как ионизация препарата изменяется в зависимости от щелочной или кислой среды. Повышенная экскреция происходит со слабокислотными препаратами в щелочной моче и слабоосновными лекарствами в кислой моче.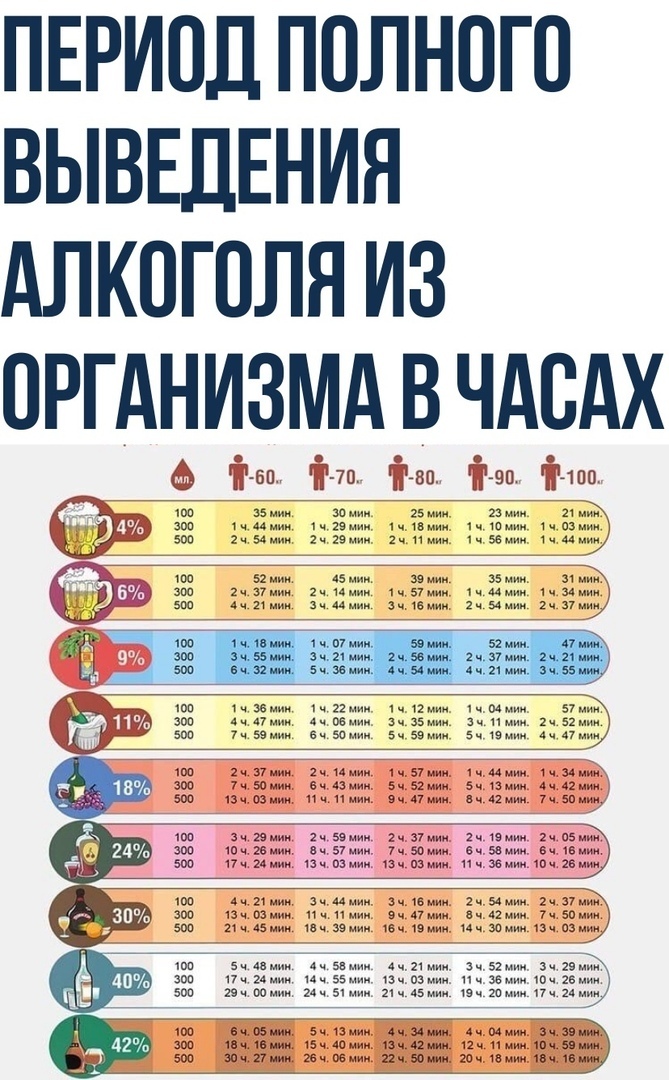
Экскреция с желчью – еще одна важная форма выведения лекарственного средства. Печень может активно секретировать ионизированные препараты с молекулярной массой более 300 г/моль в желчь, откуда они попадают в пищеварительный тракт и либо выводятся с калом, либо реабсорбируются в рамках энтерогепатического цикла.
Другие пути выделения включают легкие, грудное молоко, пот, слюну и слезы.[6][7][8][9]
Клиническое значение
Заболевания печени, такие как цирроз печени, влияют на выведение лекарств через печень. Нарушение метаболических путей фазы I и II может привести к увеличению периода полувыведения препаратов длительного действия, что способствует токсичности. Снижение уровня белка плазмы при заболевании печени может привести к увеличению несвязанной фракции лекарственного средства в плазме. По мере того, как болезнь печени усугубляется, доза препарата должна быть уменьшена для получения того же эффекта. Изменения перфузии печени также могут влиять на метаболизм лекарственных средств. Состояния сниженного притока крови к печени, такие как шок, гиповолемия или гипотензия, могут привести к снижению скорости метаболизма.
Состояния сниженного притока крови к печени, такие как шок, гиповолемия или гипотензия, могут привести к снижению скорости метаболизма.
Заболевания почек, такие как хроническое заболевание почек, могут снижать функцию почек, препятствуя выведению лекарственного средства. Поскольку функция почек ухудшается с возрастом, выведение препарата становится менее эффективным, и может потребоваться коррекция дозы. Помимо непосредственной почечной дисфункции, патологии, влияющие на почечный кровоток или мочеиспускание, также могут влиять на элиминацию лекарств. Примерами таких нарушений являются застойная сердечная недостаточность, заболевания печени и патологии, влияющие на выброс антидиуретического гормона.[10]
Сестринское дело, смежное здравоохранение и межпрофессиональные групповые вмешательства
У стареющих пациентов наблюдается снижение функции печени и почек. Критерии Берса были разработаны для стратификации риска у пожилых людей и полезны при дозировании лекарств у лиц старше 65 лет. Точно так же при назначении лекарств пациентам с заболеваниями печени или почек или с патологиями, которые могут повлиять на эти органы, необходимо учитывать корректировку дозы. На всех вкладышах к лекарственным препаратам от производителя обсуждаются конкретные проблемы, связанные с дозированием почечных и печеночных препаратов, о которых необходимо знать медицинским работникам для своих пациентов. [11]
Точно так же при назначении лекарств пациентам с заболеваниями печени или почек или с патологиями, которые могут повлиять на эти органы, необходимо учитывать корректировку дозы. На всех вкладышах к лекарственным препаратам от производителя обсуждаются конкретные проблемы, связанные с дозированием почечных и печеночных препаратов, о которых необходимо знать медицинским работникам для своих пациентов. [11]
Сестринское дело, смежные службы здравоохранения и мониторинг межпрофессиональных групп
При уходе за пациентами с заболеваниями печени или почек или состояниями, поражающими эти органы, медсестры должны учитывать тот факт, что это может повлиять на выведение лекарств. Дозы препаратов могут потребовать уменьшения (и/или частоты приема), а некоторые препараты могут потребовать отмены. Если введение конкретного препарата абсолютно необходимо, необходимо тщательное наблюдение за побочными эффектами. У пациентов, не страдающих патологией печени или почек, концентрацию в плазме таких препаратов, как ванкомицин или фенитоин, по-прежнему необходимо контролировать, чтобы убедиться, что они остаются в пределах терапевтического диапазона. [12]
[12]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Алмазроо О.А., Миах М.К., Венкатараманан Р. Метаболизм лекарств в печени. Клин печени Dis. 2017 Февраль;21(1):1-20. [PubMed: 27842765]
- 2.
Corsini A, Bortolini M. Медикаментозное поражение печени: роль метаболизма и транспорта лекарств. Дж. Клин Фармакол. 2013 май; 53(5):463-74. [В паблике: 23436293]
- 3.
Bernhardt R. Цитохромы Р450 как универсальные биокатализаторы. Дж Биотехнолог. 2006 25 июня; 124 (1): 128-45. [PubMed: 16516322]
- 4.
Zeng M, Yang L, He D, Li Y, Shi M, Zhang J. Метаболические пути и фармакокинетика натуральных лекарств с низкой проницаемостью. Drug Metab Rev. 2017 Nov; 49(4):464-476. [PubMed: 28911247]
- 5.
Leeson PD.
 Молекулярная инфляция, истощение и правило пяти. Adv Drug Deliv Rev. 2016 01 июня; 101: 22-33. [В паблике: 26836397]
Молекулярная инфляция, истощение и правило пяти. Adv Drug Deliv Rev. 2016 01 июня; 101: 22-33. [В паблике: 26836397]- 6.
Комитет по наркотикам Американской академии педиатрии. Попадание лекарств и других химических веществ в грудное молоко. Педиатрия. 2001 г., сен; 108 (3): 776-89. [PubMed: 11533352]
- 7.
Johnson HL, Maibach HI. Экскреция препарата с эккринным потом человека. Джей Инвест Дерматол. 1971 март; 56 (3): 182-8. [PubMed: 5556511]
- 8.
Идкайдек Н.М. Сравнительная оценка слюны и плазмы для исследований биодоступности и биоэквивалентности лекарств у человека. Saudi Pharm J. 2017 июль; 25 (5): 671-675. [Бесплатная статья PMC: PMC5506617] [PubMed: 28725138]
- 9.
Стоу К.М., Плаа Г.Л. Внепочечное выведение лекарственных средств и химических веществ. Анну Рев Фармакол. 1968; 8: 337–356. [PubMed: 4875395]
- 10.
Асконапе Дж. Дж. Применение противоэпилептических препаратов при заболеваниях печени и почек.


 [В паблике: 23436293]
[В паблике: 23436293] М. Сравнительная оценка слюны и плазмы для исследований биодоступности и биоэквивалентности лекарств у человека. Saudi Pharm J. 2017 июль; 25 (5): 671-675. [Бесплатная статья PMC: PMC5506617] [PubMed: 28725138]
М. Сравнительная оценка слюны и плазмы для исследований биодоступности и биоэквивалентности лекарств у человека. Saudi Pharm J. 2017 июль; 25 (5): 671-675. [Бесплатная статья PMC: PMC5506617] [PubMed: 28725138] , Крюгер В.А., Фрей ОР. Лекарственный мониторинг и индивидуальное дозирование антибиотиков при сепсисе: современно или просто «модно»? Мед Клин Интенсивмед Нотфмед. 2018 март; 113(2):82-93. [PubMed: 27624768]
, Крюгер В.А., Фрей ОР. Лекарственный мониторинг и индивидуальное дозирование антибиотиков при сепсисе: современно или просто «модно»? Мед Клин Интенсивмед Нотфмед. 2018 март; 113(2):82-93. [PubMed: 27624768] Молекулярная инфляция, истощение и правило пяти. Adv Drug Deliv Rev. 2016 01 июня; 101: 22-33. [В паблике: 26836397]
Молекулярная инфляция, истощение и правило пяти. Adv Drug Deliv Rev. 2016 01 июня; 101: 22-33. [В паблике: 26836397]