Содержание
Молекулярные формы уравнения реакций | Задачи 583
Задача 584.
Написать в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ:
a) NaHCO3 + HCl ⇔;
б) FeCl3 + 3KOH ⇔;
в) Pb(CH3COO)2 + Na2S ⇔;
г) 2КHS + H2SO4 ⇔;
д) Zn(NO3)2 + 2KOH ⇔;
е) Са(ОН)2 + СО2⇔;
ж) Са(ОН)2 + СО2(избыток) ⇔.
Для каждого случая указать причину смещения равновесия в сторону прямой реакции.
Решение:
a) NaHCO3 + HCl ⇔ NaCl + H2O + CO2↑;
HCO3— + H+ ⇔ H2O + CO2↑.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется неустойчивая угольная кислота, которая в водных растворах распадается на углекислый газ и воду:
H2CO3 ⇔ H2O + CO2↑
б) FeCl3 + 3KOH ⇔ Fe(OH)3↓ + 3H2O;
Fe3+ + 3OH— ⇔ Fe(OH)3↓.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется малорастворимое вещество Fe(OH)3.
в) Pb(CH3COO)2 + Na2S ⇔ PbS↓ + 2CH3COOH;
Pb2+ + S2- ⇔ PbS↓.
Равновесие системы смещено в сторону прямой реакции, потому что при реакции образуется малорастворимое вещество PbS.
г) 2КHS + H2SO4 ⇔ K2SO4 + 2H2S;
4H+ + 2S2- ⇔ 2H2S.
Равновесие системы смещено в сторону образования малодиссциируемого электролита H2S.
д) Zn(NO3)2 + 2KOH ⇔ Zn(OH)2↓ + 2KNO3;
Zn2+ + 2OH— ⇔ Zn(OH)2↓.
В результате реакции образуется малорастворимое вещество гидроксид цинка, поэтому равновесие системы сместится вправо.
е) Са(ОН)2 + СО2⇔ СаСО3↓ + Н2О;
Са2+ + 2ОН— + СО2⇔ СаСО3↓.
Равновесие реакции смещено вправо, потому что образуется малорастворимое вещество карбонат кальция.
ж) Са(ОН)2 + СО2(избыток) ⇔ Са(НСО3)2;
2ОН— +2СО2– ⇔ НСО3—.
При избытке углекислого газа карбонат кальция превращается в гидрокарбонат кальция. В данной реакции при избытке углекислого газа в растворе происходит реакция:
СаСО3 + Н2О + СО2 ⇔ Са(НСО3)2.
Хотя при данном процессе образуется электролит, но равновесие реакции всё же смещено вправо, потому что согласно принципу Ле Шателье, равновесие системы при избытке углекислого газа будет смещено в сторону уменьшения его концентрации, действительно при постоянном подведении углекислого газа в систему осадка не образуется.
Задача 585.
Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, CH3COONH4, CaCl2, NaClO4, HCOOK, KBr? Для каждой из гидролизующихся солей написать уравнение гидролиза в ионно-молекулярной форме и указать реакцию ее водного раствора.
Решение:
a) NaCN — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
CN— + H2O ⇔ HCN + OH—.
При гидролизе образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
б) KNO3 — соль сильного основания и сильной кислоты, поэтому гидролизу не подвергается. рР = 7, реакция среды нейтральная.
в) KOCl — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
ClO— + H2O ⇔ HOCl + OH—
При гидролизе соли образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
г) NaNO2 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
NO2— + H2O ⇔ HNO2 + OH—.
При гидролизе образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
д) CH3COONH4 — соль слабого основания и слабой кислоты, поэтому гидролиз протекает как по катиону, так и по аниону:
NH4+ + H2O ⇔ NH4OH + H+;
СH3COO— + H2O ⇔ CH3COOH + OH—.
Так как K(NH4OH) ()= K(CH3COOH) = 1.8 .10-5, то гидролиз соли равномерно протекает как по катиону, так и по аниону, т.е. содержание ионов H+ и OH- примерно одинаково, поэтому рН ((= 7. Реакция среды нейтральная.
е) CaCl2, NaClO4 и KBr являются солями сильных оснований и сильных кислот, поэтому гидролиз этих солей не протекает и, реакция их растворов будет нейтральной, рН = 7.
ж) HCOOK — соль сильного основания и слабой кислоты, поэтому гидролиз соли протекает по аниону:
HCOO— + H2O ⇔ HCOOH + OH—
При гидролизе соли образуется дополнительное количество ионов OH-, которые придают раствору щелочную среду, рН > 7.
Влияние противогололедных химикатов хлорида натрия и формиата калия на растворимость кадмия в крупнозернистой минеральной почве
. 2006 1 августа; 366 (2-3): 819-25.
doi: 10.1016/j.scitotenv.2005.08.007.
Epub 2005, 12 сентября.
Киммо Раса
1
, Томми Пелтовуори, Хелина Хартикайнен
принадлежность
- 1 Кафедра прикладной химии и микробиологии Хельсинкского университета, P.O. Box 27, FIN-00014, Университет Хельсинки, Финляндия. киммо.раса@хельсинки.фи
PMID:
16165192
DOI:
10.
 1016/j.scitotenv.2005.08.007
1016/j.scitotenv.2005.08.007
Киммо Раса и др.
Научная общая среда.
.
. 2006 1 августа; 366 (2-3): 819-25.
doi: 10.1016/j.scitotenv.2005.08.007.
Epub 2005, 12 сентября.
Авторы
Киммо Раса
1
, Томми Пелтовуори, Хелина Хартикайнен
принадлежность
- 1 Кафедра прикладной химии и микробиологии Хельсинкского университета, P.O. Box 27, FIN-00014, Университет Хельсинки, Финляндия. киммо.раса@хельсинки.фи
PMID:
16165192
DOI:
10.
 1016/j.scitotenv.2005.08.007
1016/j.scitotenv.2005.08.007
Абстрактный
Чрезмерное использование хлорида натрия (NaCl) в качестве противогололедного реагента вызывает экологические проблемы, такие как повышенная концентрация хлорида в грунтовых водах. На уязвимых участках этого можно избежать, используя альтернативные органические химикаты против обледенения, такие как формиат калия (KHCOO). Однако воздействие KCHOO на окружающую среду малоизвестно. В этом исследовании сообщается о потенциальном воздействии NaCl и KCHOO на механизмы, контролирующие подвижность кадмия (Cd) в придорожных почвах в результате движения автотранспорта. Изменения растворимости Cd в крупнозернистой минеральной почве, обработанной этими двумя противогололедными химикатами, изучали в 50-дневном инкубационном эксперименте при четырех различных сочетаниях влажности и температуры и исходной концентрации Cd в почве 3 мг/кг(-1). После инкубации распределение Cd в почве по разным фракциям анализировали методом последовательной экстракции. Были зарегистрированы pH почвы и окислительно-восстановительный потенциал почвы, а наличие комплексов Cd-Cl в почве было оценено с использованием опубликованных констант стабильности. При инкубации KCHOO снижал окислительно-восстановительный потенциал почвы, но это не сопровождалось снижением сорбционной способности оксидов и выходом связанного оксидом Cd в почвенный раствор. С другой стороны, повышенный рН (от 4,3 до 6,7-8,5) при обработке формиатом увеличивал сорбцию Cd на оксидных поверхностях (до 80% от общего количества сорбированного Cd). При обработке NaCl конкуренция катионов и образование комплексов Cd-Cl увеличивали водорастворимую фракцию Cd. Следовательно, количество биодоступного Cd было в 3,5 раза меньше в KCHOO, чем в обработках NaCl.
Были зарегистрированы pH почвы и окислительно-восстановительный потенциал почвы, а наличие комплексов Cd-Cl в почве было оценено с использованием опубликованных констант стабильности. При инкубации KCHOO снижал окислительно-восстановительный потенциал почвы, но это не сопровождалось снижением сорбционной способности оксидов и выходом связанного оксидом Cd в почвенный раствор. С другой стороны, повышенный рН (от 4,3 до 6,7-8,5) при обработке формиатом увеличивал сорбцию Cd на оксидных поверхностях (до 80% от общего количества сорбированного Cd). При обработке NaCl конкуренция катионов и образование комплексов Cd-Cl увеличивали водорастворимую фракцию Cd. Следовательно, количество биодоступного Cd было в 3,5 раза меньше в KCHOO, чем в обработках NaCl.
Похожие статьи
Накопление кадмия дыней в условиях солевого стресса в загрязненной органической почве.
Ондрасек Г.
 , Ромич Д., Ренгель З., Ромич М., Зовко М.
, Ромич Д., Ренгель З., Ромич М., Зовко М.
Ондрасек Г. и соавт.
Научная общая среда. 2009 15 марта; 407 (7): 2175-82. doi: 10.1016/j.scitotenv.2008.12.032. Epub 2009 21 января.
Научная общая среда. 2009.PMID: 19162301
Рекультивация кадмиевого загрязнения рисовых почв путем промывки химикатами: выбор промывочных химикатов.
Макино Т., Сугахара К., Сакураи Ю., Такано Х., Камия Т., Сасаки К., Ито Т., Секия Н.
Макино Т. и др.
Загрязнение окружающей среды. 2006 ноябрь; 144(1):2-10. doi: 10.1016/j.envpol.2006.01.017. Epub 2006 31 марта.
Загрязнение окружающей среды. 2006.PMID: 16580105
Мобилизация тяжелых металлов противогололедными солями в придорожной среде.
Бэкстрем М., Карлссон С., Бэкман Л.
 , Фолкесон Л., Линд Б.
, Фолкесон Л., Линд Б.
Бэкстрем М. и соавт.
Вода Res. 2004 г., февраль; 38(3):720-32. doi: 10.1016/j.waters.2003.11.006.
Вода Res. 2004.PMID: 14723942
Временная эволюция окислительно-восстановительных процессов и динамика свободного Cd в загрязненной металлами почве после повторного увлажнения.
Корню Дж. Ю., Дене Л., Шнайдер А., Пеллерин С.
Корню Дж. Ю. и соавт.
Хемосфера. 2007 г., декабрь 70(2):306-14. doi: 10.1016/j.chemosphere.2007.06.003. Epub 2007 23 июля.
Хемосфера. 2007.PMID: 17643473
Видообразование кадмия в окружающей среде.
Креа Ф., Фоти С., Милеа Д., Саммартано С.
Креа Ф. и др.
Встретил Ионов Life Sci. 2013;11:63-83. doi: 10.1007/978-94-007-5179-8_3.
Встретил Ионов Life Sci. 2013.
2013.PMID: 23430770
Обзор.
Посмотреть все похожие статьи
Цитируется
Краткосрочные реакции химического состава почвы, макроэлементов хвои и роста деревьев на клинкерную пыль и удобрения в насаждении сосны обыкновенной.
Клышейко Ю., Отс К., Кузнецова Т., Пярн Х., Мандре М.
Klõšeiko J, et al.
Оценка окружающей среды. 2011 Октябрь; 181 (1-4): 83-99. doi: 10.1007/s10661-010-1815-7. Epub 2010 16 декабря.
Оценка окружающей среды. 2011.PMID: 21161587
Влияние хлоридных антиобледенителей на минеральное питание и состояние здоровья придорожных деревьев в г. Кельце, Польша.
Галушка А., Мигашевский З.М., Подляски Р., Доленговска С., Михалик А.
Галушка А. и соавт.
и соавт.
Оценка окружающей среды. 2011 май; 176 (1-4): 451-64. doi: 10.1007/s10661-010-1596-z. Epub 2010 10 июля.
Оценка окружающей среды. 2011.PMID: 20617457
Типы публикаций
термины MeSH
вещества
Формиат калия, ГР 99%+ 590-29-4 производители в Индии | Формиат калия, ГР 99%+
Документы
- Сертификат анализа
- Лист спецификаций
Назад
Код: P 2248
Синонимы: калиевая соль муравьиной кислоты
CAS
590-29-4
Марка
AR / GR
Мол. Формула
Формула
HCOOK
Код HSN
29151290
Чистота
99%+
Мол. Вес
84.12
Упаковка
Бутылка / бочка
Налоговая ставка
18%
Документы
- Сертификат анализа
- Лист спецификаций
КАС
590-29-4
Марка
AR / GR
Мол. Формула
HCOOK
Код HSN
29151290
Чистота
99%+
Мол. Вес
Вес
84.12
Упаковка
Бутылка/бочка
Налоговая ставка
18%
| Уплотнения | Цена (INR) |
|---|---|
| 500 г | 1296,00 |
| 5 кг | 11709.00 |
| 4 х 25 кг | ПОР |
Уплотнения
Запросить
Название компании
Контактное лицо
Контактный номер
Эл. адрес
адрес
Количество
Запрос кода продукта: P 2248
Формиат калия, GR 99%+
Свойства
Категории
Неорганические химикаты, соединения калия
Анализ
≥99,0% (NT)
Внешний вид (форма)
Кристаллический порошок
Внешний вид (цвет)
Белый
Петиция
165-168 ° C (горит.) Формиат калия, HCO2K (или KHCOO), представляет собой калиевую соль муравьиной кислоты.
Применение
P 2248 (OTTO) Формиат калия, GR 99%+ Cas 590-29-4 — используется в нефтедобыче. P 2248 (OTTO) Формиат калия, GR 99%+ Cas 590-29-4 — действует как промежуточное звено в процессе получения калия формиатом.
Информация по безопасности
WGK Германия 2
Документация
Сертификат анализа
(например, B 1615-0108)
Другие документы
- Лист спецификаций
Сопутствующие товары
Технические услуги
Наша команда экспертов по НИОКР и ученых обладает опытом во всех областях исследований лабораторных химикатов, нанотехнологий, медико-биологических наук, индивидуального синтеза, хроматографии и многих других.
Узнать сейчас
Отказ от ответственности Вышеуказанные сведения не освобождают покупателя от обязанности проведения проверки полученных товаров.
Не для медицинского, бытового или любого другого использования, только для лабораторного использования. Пожалуйста, проверьте перед использованием.
| Уплотнения | Цена (INR) |
|---|---|
| 500 г | 1296,00 |
| 5 кг | 11709. |

 1016/j.scitotenv.2005.08.007
1016/j.scitotenv.2005.08.007 1016/j.scitotenv.2005.08.007
1016/j.scitotenv.2005.08.007 , Ромич Д., Ренгель З., Ромич М., Зовко М.
, Ромич Д., Ренгель З., Ромич М., Зовко М.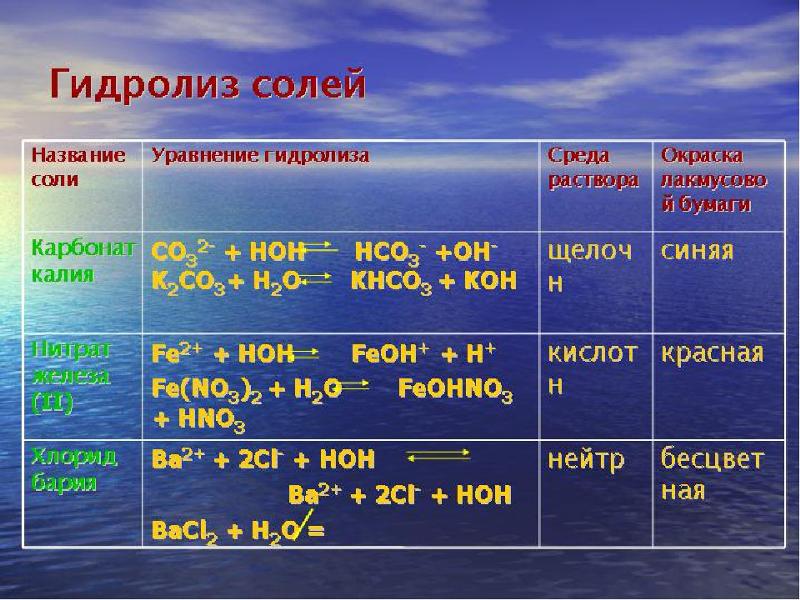 , Фолкесон Л., Линд Б.
, Фолкесон Л., Линд Б. 2013.
2013. и соавт.
и соавт.