Содержание
Аммиак и его воздействие на организм человека
Аммиак в переводе с греческого (hals ammoniakos) — амонова соль. Аммиак — бесцветный газ с резким запахом, температура плавления — 80° С, температура кипения — 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Чистый аммиак был получен английским химиком и философом Джозефом Пристли в 1774 году. Промышленную технологию получения аммиака разработали и осуществили в 1913 году немецкие химики Фриц. Габер и Карл Бош, получившие за свои исследования Нобелевские премии.
Аммиак — один из самых важных продуктов химической промышленности. Большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — Nh5Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Аммиак используется для охлаждения каналов энергоснабжения Международной космической станции (МКС), которые обеспечивают МКС электричеством.
На станции есть два независимых аммиачных контура охлаждения, которые отводят тепло от охлаждаемого водой внутреннего оборудования, а также от электрических приборов, установленных на внешней поверхности МКС.
Жидкий аммиак вызывает сильные ожоги кожи, поэтому его обычно перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись «Аммиак» черного цвета), железнодорожных и автомобильных цистернах, по воде — в специальных танкерах, транспортируют также по трубопроводам.
Смесь аммиака с воздухом взрывоопасна. Аммиак горит при наличии постоянного источника огня. Емкости могут взрываться при нагревании.
Газообразный аммиак является токсичным соединением. При его концентрации в воздухе рабочей зоны около 350 мг/куб. м (миллиграмм на кубический метр) и выше работа должна быть прекращена, а люди выведены за пределы опасной зоны. Предельно допустимая концентрация аммиака в воздухе рабочей зоны равна 20 мг/куб. м.
Аммиак опасен при вдыхании. При остром отравлении аммиаком поражаются глаза и дыхательные пути, при высоких концентрациях возможен смертельный исход. Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями. При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
При попадании аммиака в желудок надо выпить несколько стаканов теплой воды с добавлением одной чайной ложки столового уксуса на стакан воды и вызвать рвоту.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Зону поражения необходимо изолировать. В зону аварии входить только в полной защитной одежде.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду.
Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Материал подготовлен на основе информации РИА Новости и открытых источников
Аммиак — Что такое Аммиак?
, Обновлено 21 января 11:52
232612
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом.
Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость Nh4 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3х атомов водорода (связи N − H), 4я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония Nh5+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость.
Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподеленных электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвленную сеть водородных связей между несколькими молекулами.
Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твердый аммиак — кубические кристаллы.
#Аммиак
Последние новости
Факты об аммиаке
Техническая информация
Копия документа Факты об аммиаке (техническая информация) доступна в формате Adobe Portable Document Format (PDF, 63 КБ, 3 стр.)
Примечание для читателя: Этот информационный бюллетень предназначен для обеспечения общей осведомленности и обучения по конкретному химическому агенту. Для получения информации о готовности и реагировании (например, для сотрудников службы экстренного реагирования и скорой медицинской помощи) см. следующие ресурсы Департамента:
- Карточка готовности и реагирования на химический терроризм (PDF, 45 КБ, 7 стр.)
- Настенная диаграмма «Химический терроризм» (PDF, 97 КБ, 1 стр.)
Что такое аммиак?
Аммиак (NH 3 ) является одним из наиболее часто производимых промышленных химикатов в Соединенных Штатах. Он используется в промышленности и торговле, а также естественным образом присутствует в организме человека и в окружающей среде. Аммиак необходим для многих биологических процессов и служит предшественником для синтеза аминокислот и нуклеотидов. В окружающей среде аммиак является частью азотного цикла и образуется в почве в результате бактериальных процессов. Аммиак также образуется в результате разложения органических веществ, включая растения, животных и отходы животноводства.
Он используется в промышленности и торговле, а также естественным образом присутствует в организме человека и в окружающей среде. Аммиак необходим для многих биологических процессов и служит предшественником для синтеза аминокислот и нуклеотидов. В окружающей среде аммиак является частью азотного цикла и образуется в почве в результате бактериальных процессов. Аммиак также образуется в результате разложения органических веществ, включая растения, животных и отходы животноводства.
Некоторые химические/физические свойства аммиака:
- При комнатной температуре аммиак представляет собой бесцветный сильно раздражающий газ с резким удушливым запахом.
- В чистом виде известен как безводный аммиак и гигроскопичен (легко впитывает влагу).
- Аммиак обладает щелочными свойствами и вызывает коррозию.
- Газообразный аммиак легко растворяется в воде с образованием гидроксида аммония, щелочного раствора и слабого основания.
- Газообразный аммиак легко сжимается и под давлением образует прозрачную жидкость.

- Аммиак обычно транспортируют в виде сжатой жидкости в стальных контейнерах.
- Аммиак не легко воспламеняется, но контейнеры с аммиаком могут взорваться при воздействии высокой температуры.
Как используется аммиак?
Около 80% аммиака, производимого промышленностью, используется в сельском хозяйстве в качестве удобрения. Аммиак также используется в качестве газообразного хладагента для очистки воды и в производстве пластмасс, взрывчатых веществ, текстиля, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Бытовые чистящие растворы аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака. Растворы аммиака для промышленного использования могут иметь концентрацию 25% или выше и вызывать коррозию.
Как люди могут подвергаться воздействию аммиака?
Большинство людей подвергаются воздействию аммиака при вдыхании газа или паров. Поскольку аммиак существует в природе, а также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, в промышленных и коммерческих помещениях также означает, что воздействие может произойти в результате случайного выброса или преднамеренного террористического нападения.
Поскольку аммиак существует в природе, а также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, в промышленных и коммерческих помещениях также означает, что воздействие может произойти в результате случайного выброса или преднамеренного террористического нападения.
Безводный газообразный аммиак легче воздуха и будет подниматься вверх, так что обычно он рассеивается и не оседает в низинах. Однако в присутствии влаги (например, при высокой относительной влажности) сжиженный безводный газообразный аммиак образует пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или в низинах с плохим воздушным потоком, где люди могут подвергнуться воздействию.
Каков механизм действия аммиака?
Аммиак сразу же при контакте с имеющейся влагой кожи, глаз, полости рта, дыхательных путей и особенно слизистых поверхностей взаимодействует с образованием очень едкого гидроксида аммония. Гидроксид аммония вызывает некроз тканей за счет разрушения липидов клеточных мембран (омыление), что приводит к разрушению клеток. Когда клеточные белки разрушаются, вода извлекается, что приводит к воспалительной реакции, вызывающей дальнейшее повреждение.
Когда клеточные белки разрушаются, вода извлекается, что приводит к воспалительной реакции, вызывающей дальнейшее повреждение.
Каковы непосредственные последствия воздействия аммиака на здоровье?
Вдыхание: Аммиак вызывает раздражение и коррозию. Воздействие высоких концентраций аммиака в воздухе вызывает немедленное жжение в носу, горле и дыхательных путях. Это может вызвать бронхиолярный и альвеолярный отек и разрушение дыхательных путей, приводящее к дыхательной недостаточности или недостаточности. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осознание длительного воздействия низких концентраций.
Дети, подвергшиеся воздействию тех же концентраций паров аммиака, что и взрослые, могут получить большую дозу, поскольку у них больше отношение площади поверхности легких к массе тела и повышенное отношение минутного объема к массе. Кроме того, они могут подвергаться воздействию более высоких концентраций, чем взрослые в том же месте, из-за их меньшего роста и более высоких концентраций паров аммиака, изначально обнаруженных у земли.
Кроме того, они могут подвергаться воздействию более высоких концентраций, чем взрослые в том же месте, из-за их меньшего роста и более высоких концентраций паров аммиака, изначально обнаруженных у земли.
Контакт с кожей или глазами: Воздействие низких концентраций аммиака в воздухе или в растворе может вызвать быстрое раздражение кожи или глаз. Более высокие концентрации аммиака могут вызвать серьезные травмы и ожоги. Контакт с концентрированными растворами аммиака, такими как промышленные чистящие средства, может привести к коррозионным повреждениям, включая ожоги кожи, необратимое повреждение глаз или слепоту. Полная степень повреждения глаз может не проявляться в течение недели после воздействия. Контакт со сжиженным аммиаком также может вызвать обморожение.
Проглатывание: Воздействие высоких концентраций аммиака при проглатывании раствора аммиака приводит к коррозионному поражению полости рта, горла и желудка. Проглатывание аммиака обычно не приводит к системному отравлению.
Как лечить воздействие аммиака?
Противоядия от отравления аммиаком не существует, но последствия аммиака можно лечить, и большинство людей выздоравливают. Немедленное обеззараживание кожи и глаз большим количеством воды очень важно. Лечение состоит из поддерживающих мер и может включать введение увлажненного кислорода, бронходилататоров и обеспечение проходимости дыхательных путей. Попавший внутрь нашатырный спирт разбавляют молоком или водой.
Помогут ли лабораторные тесты принять решение о лечении, если кто-то подвергся воздействию аммиака?
Лабораторные анализы на воздействие аммиака бесполезны при принятии решений о неотложной помощи. Доступны медицинские тесты, которые могут обнаружить аммиак в крови или моче. Однако, поскольку аммиак обычно присутствует в организме, результаты этих анализов не могут служить биомаркерами воздействия. После воздействия низких уровней аммиак либо быстро выводится из организма, либо метаболизируется до соединений, обнаруживаемых эндогенно в заметных количествах. Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не изменились или изменились минимально по сравнению с предыдущими уровнями. Воздействие высоких концентраций оказывает немедленное и явное токсическое действие, что обычно обеспечивает достаточную основу для диагностики.
Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не изменились или изменились минимально по сравнению с предыдущими уровнями. Воздействие высоких концентраций оказывает немедленное и явное токсическое действие, что обычно обеспечивает достаточную основу для диагностики.
Как я могу получить дополнительную информацию об аммиаке?
Позвоните по следующим номерам или посетите веб-сайты, указанные в разделе «Источники».
- Горячая линия Центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний. 2004. ToxFAQ для аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/tfacts126.html
http://www.atsdr.cdc.gov/tfacts126.html
Агентство регистрации токсичных веществ и заболеваний. 2004. Руководство по медицинскому контролю (MMG) аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/MHMI/mmg126.html
Центры по контролю и профилактике заболеваний. 2003. Бюллетени готовности и реагирования на чрезвычайные ситуации в области общественного здравоохранения. Министерство здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.bt.cdc.gov/agent/ammonia/index.asp
Этот информационный бюллетень основан на самой последней информации. Он может обновляться по мере поступления новой информации.
Обновлено: 28 июля 2004 г.
Факты об аммиаке
Общая информация
Копия Факты об аммиаке (общая информация) доступна в формате Adobe Portable Document Format (PDF, 63 КБ, 3 стр. )
)
Примечание для читателя: Этот информационный бюллетень предназначен для предоставления общей информации и информации о конкретном химическом агенте. Для получения информации о готовности и реагировании (например, для сотрудников службы экстренного реагирования и скорой медицинской помощи) см. следующие ресурсы Департамента:
- Карточка готовности и реагирования на химический терроризм (PDF, 45 КБ, 7 стр.)
- Настенная диаграмма «Химический терроризм» (PDF, 97 КБ, 1 стр.)
Что такое аммиак?
Аммиак является одним из наиболее широко производимых химических веществ в Соединенных Штатах. В чистом виде он известен как безводный аммиак. Аммиак также вырабатывается в организме человека и обычно встречается в природе. Он необходим организму как строительный блок для производства белков и других сложных молекул. В природе аммиак возникает в почве в результате бактериальных процессов. Он также образуется при разложении растений, животных и животных отходов.
Какими свойствами обладает аммиак?
Аммиак представляет собой бесцветный сильнораздражающий газ с резким удушливым запахом. Он легко растворяется в воде с образованием раствора гидроксида аммония, который может вызвать раздражение и ожоги. Газообразный аммиак легко сжимается и под давлением образует прозрачную бесцветную жидкость. Обычно его транспортируют в виде сжатой жидкости в стальных баллонах. Аммиак не легко воспламеняется, но контейнеры с аммиаком могут взорваться при воздействии высокой температуры.
Как используется аммиак?
Около 80% аммиака, производимого в промышленности, используется в сельском хозяйстве в качестве удобрения. Аммиак также используется в качестве газообразного хладагента, для очистки воды и в производстве пластмасс, взрывчатых веществ, тканей, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Моющие растворы для промышленного использования содержат более высокие концентрации аммиака и могут быстро вызвать раздражение и ожоги.
Как люди могут подвергаться воздействию аммиака?
Большинство людей подвергается воздействию аммиака при вдыхании его газа или паров. Поскольку аммиак существует в природе, а также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, в промышленных и коммерческих помещениях означает, что воздействие может также произойти в результате случайного выброса или преднамеренного террористического нападения.
Газообразный аммиак легче воздуха и будет подниматься вверх, поэтому обычно не оседает в низинах. Однако в присутствии влаги аммиак может образовывать пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или другим низменным участкам.
Как действует аммиак на организм?
Когда аммиак попадает в организм в результате дыхания, проглатывания или контакта с кожей, он вступает в реакцию с водой с образованием гидроксида аммония. Это химическое вещество очень агрессивно и повреждает клетки организма при контакте.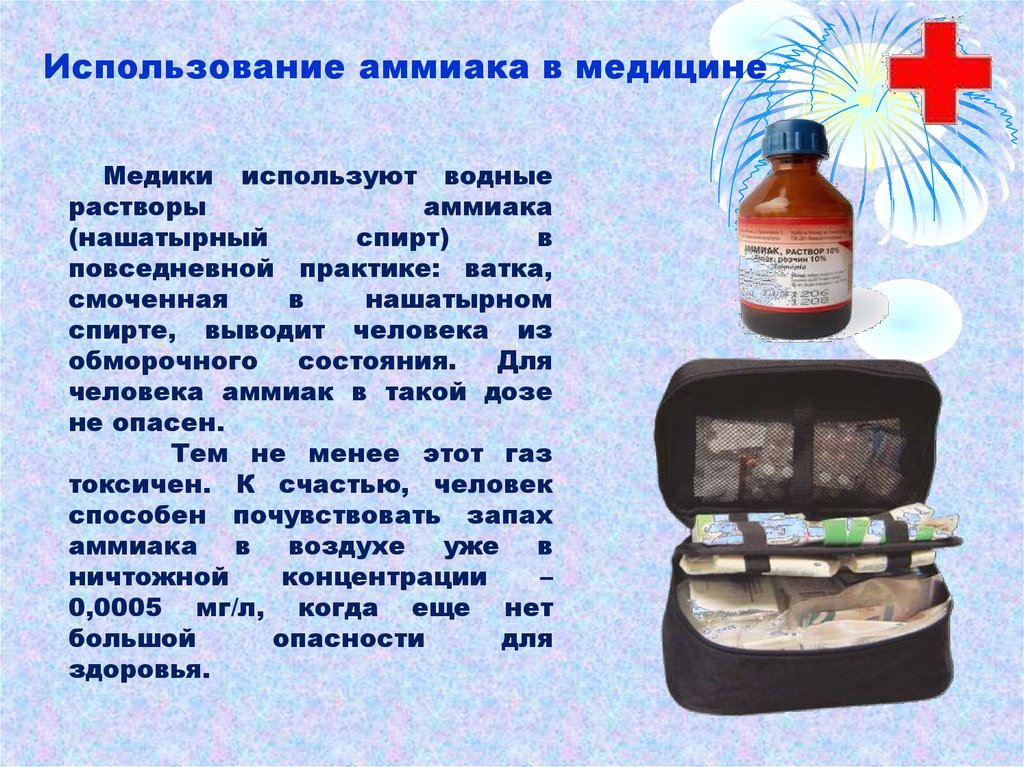
Каковы специфические признаки и симптомы отравления аммиаком?
Аммиак вызывает коррозию. Тяжесть последствий для здоровья зависит от пути воздействия, дозы и продолжительности воздействия. Воздействие высоких концентраций аммиака в воздухе вызывает немедленное жжение в глазах, носу, горле и дыхательных путях и может привести к слепоте, повреждению легких или смерти. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла.
Проглатывание аммиака может вызвать ожоги рта, горла и желудка. Контакт кожи или глаз с концентрированным аммиаком также может вызвать раздражение и ожоги.
Что делать, если вы считаете, что могли подвергнуться воздействию большого количества аммиака?
Если вы подверглись воздействию большого количества аммиака, например, в результате опрокидывания автоцистерны или протечки железнодорожной цистерны, выполните следующие действия:
- Быстро отойдите от места, где, по вашему мнению, вы подверглись воздействию.
 Если выброс был в помещении, выйдите на улицу.
Если выброс был в помещении, выйдите на улицу.- Если вы находитесь вблизи места выброса аммиака, координаторы по чрезвычайным ситуациям могут попросить вас либо эвакуироваться из района, либо «укрыться на месте». «Укрыться на месте» означает оставаться в помещении, чтобы избежать воздействия химического вещества. Находясь в помещении, закройте и заприте все двери и окна; выключите кондиционеры, вентиляторы и обогреватели; и закрыть заслонки камина.
- Для получения дополнительной информации об эвакуации во время химической аварии см. Факты об эвакуации . Для получения дополнительной информации об укрытии на месте во время химической аварийной ситуации см. 9.0156 Факты об укрытии на месте .
- Быстро снимите одежду, на которой может быть аммиак. Если возможно, одежду, которая обычно снимается через голову (например, футболки и свитера), следует срезать с тела, чтобы предотвратить дополнительный контакт с возбудителем.
- Поместите одежду в полиэтиленовый пакет и плотно завяжите его.

- Не трогайте пластиковый пакет и ждите инструкций по правильной утилизации.
- Утилизация одежды в герметичном пакете помогает защитить вас и других людей от любого дополнительного воздействия.
- Храните упакованную одежду в безопасном месте, недоступном для людей, особенно детей.
- Поместите одежду в полиэтиленовый пакет и плотно завяжите его.
- Быстро смойте аммиак с кожи большим количеством воды с мылом и промойте глаза большим количеством воды.
- Снимите и утилизируйте контактные линзы.
- Перед тем, как надеть очки, промойте их водой с мылом.
- Не используйте отбеливатель для удаления аммиака с кожи.
- При необходимости немедленно обратитесь за медицинской помощью.
Как лечить отравление аммиаком?
Чтобы уменьшить последствия воздействия аммиака, важно как можно быстрее промыть глаза и кожу большим количеством воды.
Противоядия от отравления аммиаком не существует, но последствия аммиака можно лечить, и большинство жертв выздоравливают. Людям с серьезными признаками и симптомами (такими как сильный или постоянный кашель или ожоги в горле) может потребоваться госпитализация.
Людям с серьезными признаками и симптомами (такими как сильный или постоянный кашель или ожоги в горле) может потребоваться госпитализация.
Помогут ли лабораторные исследования принять решение о лечении, если кто-то подвергся воздействию аммиака?
Лабораторные анализы на воздействие аммиака бесполезны при принятии решений о неотложной помощи. Есть тесты, которые могут обнаружить аммиак в крови и моче. Однако эти тесты не могут точно определить, подвергался ли кто-либо воздействию аммиака из внешнего источника, потому что аммиак также обычно содержится в организме. Человек, подвергшийся воздействию вредных количеств аммиака, сразу заметит это из-за сильного неприятного запаха; сильный вкус; и, вероятно, раздражение кожи, глаз, носа и горла.
Как я могу получить дополнительную информацию об аммиаке?
Позвоните по следующим номерам или посетите веб-сайты, указанные в разделе «Источники».
- Горячая линия Центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний.


 Если выброс был в помещении, выйдите на улицу.
Если выброс был в помещении, выйдите на улицу.