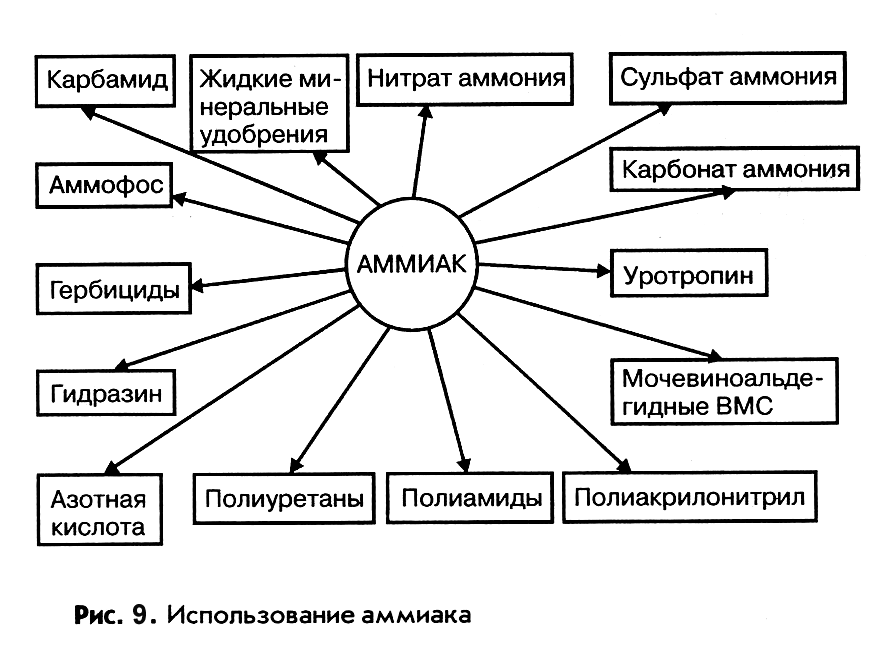
Содержание
Применение аммиака
Аммиак — одно из наиболее часто применяемых в различных сферах человеческой деятельности химических веществ. Каждый год в мире производится огромное количество аммиака— больше 180 млн тонн.Из них порядка 15 млн тонн производит Россия, которая является одним из крупнейших экспортеров этого вещества. Для чего же человеку нужно такое количество этого продукта?
Об основных свойствах аммиака
Разнообразие сфер применения аммиака обусловлено его физическими и химическими свойствами. Аммиак (химическая формула NH3) —бесцветный газ с резким неприятным запахом. При длительном действии на организм человека аммиак вызывает поражение разных органов.
Аммиак вступает в химические реакции с другими элементами и соединениями с образованием новых веществ. Например, в результате реакции безводного аммиака с азотной кислотой получают аммиачную селитру, применяемую в производстве взрывчатых веществ и азотных удобрений.
Аммиак способен восстанавливать различные металлы из их оксидов.
Промышленное применение аммиака
Основная доля производимого технического аммиака используется в химической промышленности:
- для получения аммиачных и аммиачно-нитратных удобрений (аммиачной и нитратной селитры, хлористого аммония, сульфата аммония и других), широко используемых в сельскохозяйственном производстве при выращивании различных культур, а также в частном садоводстве и огородничестве;
- при получении соды аммиачно-хлоридным способом аммиаком насыщают концентрированный солевой раствор, через который под давлением пропускают двуокись углерода;
- синтетический аммиак применяется при производстве азотной кислоты, методом катализа;
- для получения аммонитов — аммиачных взрывчатых веществ;
- жидкий аммиак используют в качестве растворителя разных неорганических и органических веществ;
- в холодильных установках жидкий аммиак применяют в качестве хладагента R717;
- в качестве окислителя ракетного топлива.
Применение аммиака в медицине
В медицине широко применяется 10%-й раствор аммиака, известный под названием — нашатырный спирт. Нашатырный спирт используют для приведения в чувство человека, потерявшего сознание. Применяют его и в качестве рвотного средства в очень слабом растворе и в малом количестве. Нашатырным спиртом обрабатывают укусы насекомых. Разведенным в воде нашатырным спиртом хирурги обрабатывают руки.
Нашатырный спирт используют для приведения в чувство человека, потерявшего сознание. Применяют его и в качестве рвотного средства в очень слабом растворе и в малом количестве. Нашатырным спиртом обрабатывают укусы насекомых. Разведенным в воде нашатырным спиртом хирурги обрабатывают руки.
Важно! Использовать раствор аммиака следует с большой осторожностью и только по назначению. Передозировка его очень опасна!
Аммиак полезен и в быту
Вот только несколько возможных способов использования нашатырного спирта в доме.
- Мытье окон — смешав столовую ложку вещества с литром воды, протрите полученной жидкостью стекла, а затем отполируйте их с мягкой бумагой или тканью или бумагой. Аналогично можно очистить керамическую плитку.
- Стирка деликатных тканей — жесткую воду можно смягчить, добавив в нее несколько ложек нашатырного спирта.
- Чистка столового серебра —смешайте нашатырный спирт с чистой водой в пропорции 1:4 и положите туда серебряные предметы на несколько часов, затем ополосните их и протрите до блеска.

- Чистка меха — 1 чайную ложку 10%-го раствора аммиака и несколько чайных ложек питьевой соды растворите в 0,5 литра воды. Смочите в полученном растворе салфетку из мягкой ткани и протрите мех сверху.
- Аналогично нашатырным спиртом можно удалять различные пятна с тканей и замши.
И это только небольшая часть тех случаев, когда аммиак приходит на помощь человеку.
Аммиак – где используется, чем опасен, и что делать при утечке
Вещество аммиак один из часто используемых продуктов современной химии. Основная часть вещества Nh4 используется для производства азотной кислоты, удобрений, различных красителей. Но есть и значительные определённые минусы. Аммиак опасное химическое вещество и требует особых условий при производстве, перевозке и хранении.
Аммиак – газ без цвета, но с очень резким запахом. Это холодное вещество которое поглощает тепло. Его температура кипения -36 °C, а плавления -77.73 °C. Вещество отлично растворяется в воде и спирте. Nh4 получают в процессе синтеза азота и водорода. Так же оно существует и в природе, когда происходят процессы разложения органических соединений.
Nh4 получают в процессе синтеза азота и водорода. Так же оно существует и в природе, когда происходят процессы разложения органических соединений.
Чистейший аммиак в 1774 году получил химик философ из Англии Джозеф Пристли. Но в промышленных масштабах аммиак производят с начала 20 века. Химики из Германии Карл Бош и Фриц Габер в 1913 году разработали промышленную технологию и запустили процесс производства. За данную разработку они были награждены Нобелевской премией.
Процесс получения Nh4 очень энергоемкий, что является основным его недостатком. Из-за этого на протяжение долгих лет ученые ведут разработки по уменьшению затрат при производстве аммиака. В основе производства заложен принцип циркуляции. Все процессы должны идти непрерывно. Остатки исходных компонентов фильтруются от основного вещества и вновь уходят в процесс производства. Из-за чего синтез продукта цикличный и его нельзя резко останавливать.
В качестве сырья используют углеводород – природный газ.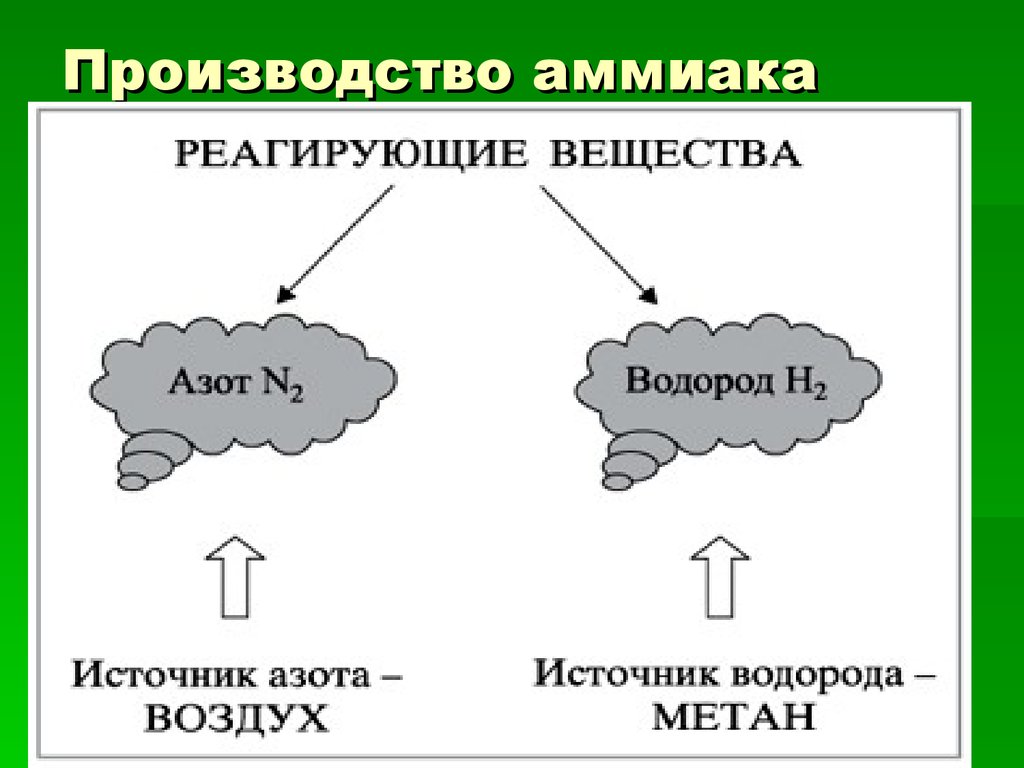 Прежде чем попасть в процесс производства Nh4, газ несколько раз обрабатывают и выделяют водород. Далее водород подают в колонну синтеза под высоким давление совместно с азотом. Все процессы проходят при высоких температурах поэтому процесс получения аммиака является энергозатратным и очень опасным химическим производством.
Прежде чем попасть в процесс производства Nh4, газ несколько раз обрабатывают и выделяют водород. Далее водород подают в колонну синтеза под высоким давление совместно с азотом. Все процессы проходят при высоких температурах поэтому процесс получения аммиака является энергозатратным и очень опасным химическим производством.
Где используется вещество Nh4
Аммиак – очень важное вещество в современной химической промышленности. Основная часть вещества используется для производства азотной кислоты, удобрений, красителей. Для получения взрывчатых веществ тоже используется аммиак. Водные растворы аммиака используются в ряде производственных процессов других веществ.
Из всем известных товаров, с помощью аммиака получают:
- пищевую соду, делают большую часть краски для волос,
- нашатырный спирт,
- удобрения на основе аммиака,
- аммиачная селитра,
- мочевина.
Чем опасен аммиак и что делают при утечке вещества
Для исключения разлива аммиака при транспортировке используют специальные стальные баллоны и цистерны.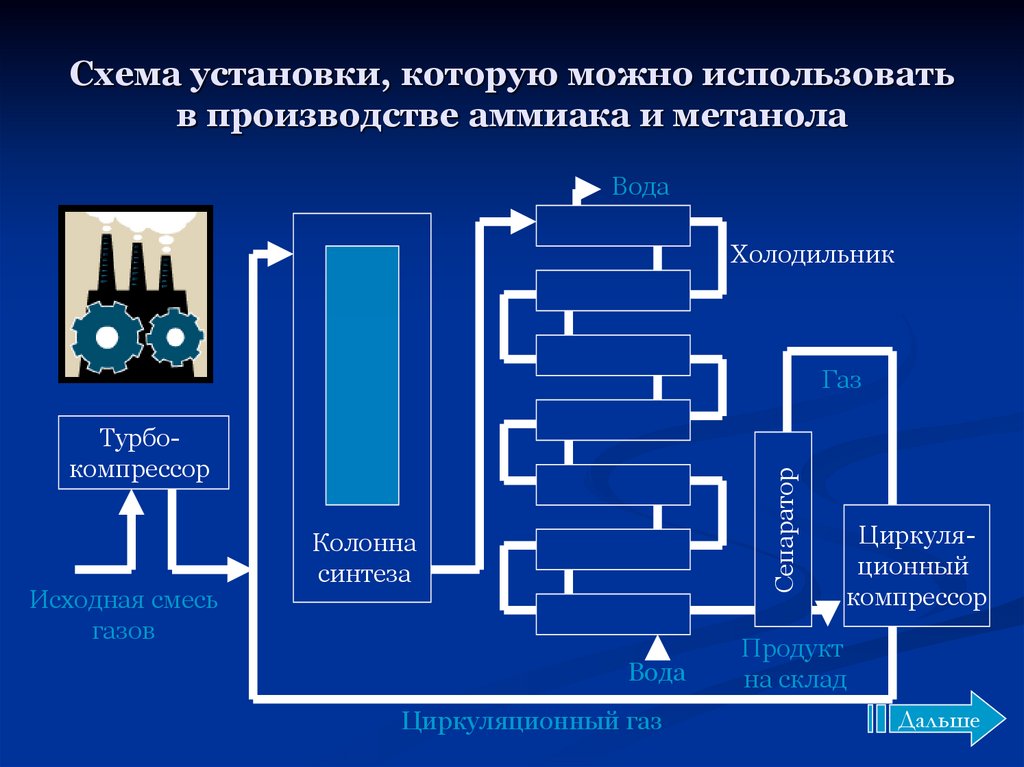 Также транспортируют в специальных танкерах. На производствах для транспортировки используют трубопроводы. Аммиак при контакте с воздухом превращается в взрывоопасную смесь. Воспламеняется при наличии источника огня. Емкости с аммиаком могут взорваться при перегреве из-за низкой температуры кипения вещества.
Также транспортируют в специальных танкерах. На производствах для транспортировки используют трубопроводы. Аммиак при контакте с воздухом превращается в взрывоопасную смесь. Воспламеняется при наличии источника огня. Емкости с аммиаком могут взорваться при перегреве из-за низкой температуры кипения вещества.
Газообразный аммиак очень ядовитое токсичное соединение. При концентрации аммиака в воздухе более 350 мг/м3 все работы должны быть прекращены. Люди должны выйти за пределы загазованной территории.
Аммиак при вдохе поражает дыхательные пути и так же влияет на зрение, при резкой высокой концентрации человек может погибнуть от отравления. Симптомы отравления:
- сильный удушливый кашель,
- воздействие высокой концентрации — перевозбуждение и бред,
- контакт с кожей – сильный ожог с пузырями, отеки,
- частое нахождение в зоне выброса аммиака невысокой концентрации — наблюдается расстройство пищеварения, ослабление слуха, катар верхних дыхательных путей.

При отравлении аммиаком необходимо срочно покинуть опасную зону и промыть глаза и открытые участки кожи водой, далее стоит обратиться к медикам.
В случае утечки, взрыва, пожара с наличием аммиака проводить ликвидацию аварии можно только в изолирующих химически защитных костюмах, например, изолирующие костюмы Стрелец.
В костюмах Стрелец АЖ ТАСК или Стрелец КИО ТАСК можно безопасно проводить работы в зонах распространения высококонцентрированного аммиака по устранению утечки и ликвидации последствий. Аммиак нейтрализуют большим количеством воды, которая распыляется под давлением в виде распыления с максимального расстояния от очага возгорания.
Аммиак — Американское химическое общество
Аммиак — бесцветный ядовитый газ со знакомым ядовитым запахом. Это происходит в природе, в основном в результате анаэробного распада растительного и животного сырья; и он также был обнаружен в космосе. Некоторые растения, в основном бобовые, в сочетании с бактериями-ризобиями «фиксируют» атмосферный азот с образованием аммиака.
Некоторые растения, в основном бобовые, в сочетании с бактериями-ризобиями «фиксируют» атмосферный азот с образованием аммиака.
Аммиак известен своим запахом с древних времен. Он был выделен в 18 веке известными химиками Джозефом Блэком (Шотландия), Питером Вульфом (Ирландия), Карлом Вильгельмом Шееле (Швеция/Германия) и Джозефом Пристли (Англия). В 1785 году французский химик Клод Луи Бертолле определил его химический состав.
Аммиак производится в промышленных масштабах посредством каталитической реакции азота и водорода при высокой температуре и давлении. Процесс был разработан в 1909 году немецкими химиками Фрицем Габером и Карлом Бошем. Оба получили Нобелевскую премию по химии за свою работу, но в разные годы: Габер в 1918 году и Бош в 1931 году. Фундаментальный процесс Габера-Боша используется до сих пор.
В 2020 году мировые мощности по производству аммиака составили 224 миллиона тонн (Мт). Фактический объем производства составил 187 млн т. Он занимает девятое место среди химикатов, производимых в мире.
Большая часть производимого аммиака — ≈85% — прямо или косвенно используется в сельском хозяйстве. Химические удобрения, изготовленные из аммиака, включают мочевину, фосфат аммония, нитрат аммония и другие нитраты. Другие важные химические вещества, получаемые из аммиака, включают азотную кислоту, гидразин, цианиды и аминокислоты.
Аммиак когда-то широко использовался в качестве хладагента. Он был в значительной степени вытеснен хлорфторуглеродами и гидрохлорфторуглеродами, которые также находятся под пристальным вниманием со стороны окружающей среды. Вероятно, самое известное применение аммиака в быту – это средства для мытья стекол.
Аммиак хорошо растворим в воде; его точная растворимость зависит от температуры (см. быстрые факты). Водный аммиак также называют гидроксидом аммония, но эту молекулу нельзя выделить. Когда аммиак используется в качестве лиганда в координационных комплексах, его называют «аммином».
В настоящее время аммиак производится из водорода, полученного из ископаемого топлива, и поэтому не является «зеленым» продуктом, несмотря на его широкое использование в сельском хозяйстве. Но экологически чистый аммиак может появиться на горизонте, если водород будет производиться другими способами, такими как электролиз воды с помощью ветра или солнечной энергии.
Но экологически чистый аммиак может появиться на горизонте, если водород будет производиться другими способами, такими как электролиз воды с помощью ветра или солнечной энергии.
Аммиак можно сжигать в качестве топлива в стандартных двигателях. Исследование, проведенное компанией-производителем катализаторов Haldor Topsoe (Kongens Lyngby, Дания), показало, что замена обычного судового топлива зеленым аммиаком будет рентабельной и устранит значительный источник парниковых газов. Потенциально его также можно использовать в авиационном топливе. В переходный период аммиак можно будет смешивать с обычным топливом.
| Класс опасности* | Краткая характеристика опасности | |
|---|---|---|
| Газы под давлением, сжиженный газ | h380 — содержит газ под давлением; может взорваться при нагревании | |
| Разъедание/раздражение кожи, категория 1B | h414 — вызывает сильные ожоги кожи | |
| Серьезное повреждение/раздражение глаз, категория 1 | h418 — вызывает серьезное повреждение глаз | |
| Острая токсичность при вдыхании, категория 3 | h431 — Токсично при вдыхании | |
| Опасность для водной среды, острая опасность, категория 1 | h500 — очень токсичен для водных организмов | |
| Опасность для водной среды, долговременная опасность, категория 2 | h511 — Токсично для водных организмов с долгосрочными последствиями | |
*Глобально согласованная система классификации и маркировки химических веществ. Пояснения к пиктограммам.
Обновление MOTW
L -Триптофан был Молекулой недели 20 ноября 2017 года. Это незаменимая аминокислота, которая должна быть частью рациона человека. Помимо других функций, он позволяет организму синтезировать серотонин и мелатонин. Недавно триптофан появился в двух биохимических исследованиях.
Недавно триптофан появился в двух биохимических исследованиях.
В одном исследовании исследователи из Университета штата Пенсильвания (Университетский парк) и Массачусетского технологического института (Кембридж) обнаружили, что фермент триптофан 2C метилтрансфераза, который катализирует добавление метильной группы к индольному кольцу триптофана в синтезе антибиотика тиострептона , не использует радикальный механизм, как большинство ферментов этого класса. Вместо этого карбоксилатная группа в ферменте действует как общее основание для депротонирования триптофанового субстрата.
Во втором исследовании А. Кит Дункер из Университета Индианы (Блумингтон) и Клара Хлухова из Карлова университета (Прага) вместе пытались выяснить, как зародилась жизнь на Земле. Они предположили, что изначально неупорядоченные белки (IDP), которые не придерживаются определенной конформации, а перемещаются, были вовлечены в этот процесс на ранней стадии. Они считают, что неструктурированные белки, образованные IDP, в конечном итоге были дополнены образующимися позже ароматическими аминокислотами триптофаном и тирозином, которые крупнее и придают белкам большую степень структуры. Они проверили свои идеи, заменив ароматические аминокислоты в ключевом ферменте лейцином; модифицированный, менее структурированный фермент сохранил некоторую активность, но в конечном итоге не работал так же эффективно, как исходный.
Они проверили свои идеи, заменив ароматические аминокислоты в ключевом ферменте лейцином; модифицированный, менее структурированный фермент сохранил некоторую активность, но в конечном итоге не работал так же эффективно, как исходный.
Факты об аммиаке
| CAS Reg. № | 7664-41-7 |
| SciFinder номенклатура | Аммиак |
| Эмпирическая формула | Н 3 Н |
| Молярная масса | 17,03 г/моль |
| Внешний вид | Бесцветный газ |
| Температура кипения | –33,3 °С |
| Растворимость в воде | ≈530 г/л (20 ºC) ≈320 г/л (25 ºC) |
Обновление MOTW:
15 марта 2021 г.
Аммиак в основном используется в сельском хозяйстве, но теперь он может иметь более «зеленое» применение — в качестве топлива для транспорта.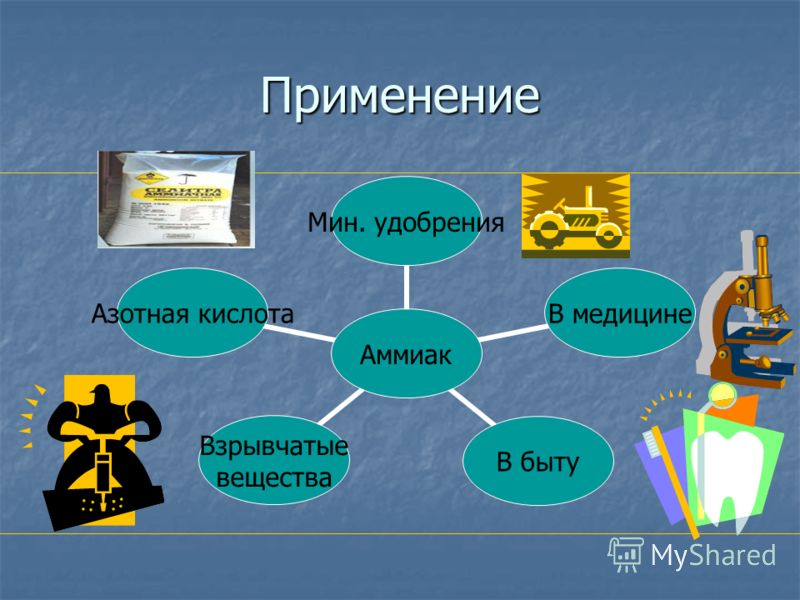 На прошлой неделе статья в Chemical & Engineering News представила промышленное обновление вариантов и препятствий, которые определят , действительно ли аммиак является «топливом будущего».
На прошлой неделе статья в Chemical & Engineering News представила промышленное обновление вариантов и препятствий, которые определят , действительно ли аммиак является «топливом будущего».
Вода и воздух — это все, что вам нужно для производства аммиака — одного из самых важных химических веществ в мире
Более зеленые удобрения идут к вам. Предоставлено: Джеймс Т.М. Товилл, CC BY-SA.
Исследователи разработали метод получения аммиака просто из воздуха и воды. Он не только более энергоэффективен, чем столетний процесс Габера-Боша, который в настоящее время используется во всем мире, но и более экологичный.
Аммиак, состоящий из трех частей водорода и одной части азота (или NH 3 ), оказал огромное влияние на общество. По оценкам, без массового производства этого химического вещества треть из нас не выживет. Это связано с тем, что его основное использование — производство удобрений, которые помогли повысить урожайность и поддерживать большую популяцию.
Разработанный в 1909 году процесс Габера-Боша, который часто называют наиболее важным изобретением 20-го века, включает нагревание очищенных газообразных азота и водорода при очень высокой температуре и давлении в присутствии железного катализатора. Необходимо наличие катализатора, который не участвует в реакции, но снижает энергетический порог реакции. Несмотря на это, производство аммиака – около 140 млн тонн в 2012 году – потребляет почти 2% мировых энергоресурсов.
Помимо больших энергетических потребностей для достижения условий реакции, текущий метод производства неэффективен, поскольку для него требуется газообразный водород, который получают путем переработки природного газа. Побочным продуктом процесса является углекислый газ. Стюарт Лихт и его коллеги из Университета Джорджа Вашингтона считали, что они могли бы добиться большего успеха, если бы нашли способ использовать воду вместо природного газа в качестве источника водорода.
Предыдущие попытки объединить воду (состоящую из двух частей водорода и одной части кислорода) с воздухом (который состоит из 78% азота) для образования аммиака были менее успешными.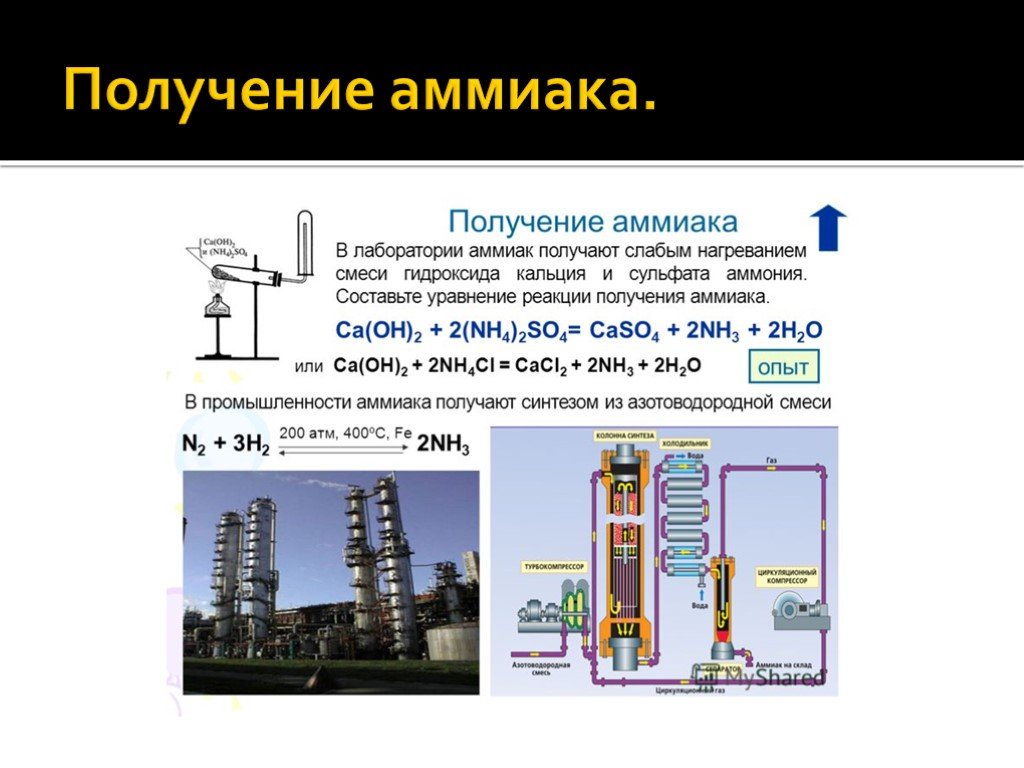 Решение Лихта состояло в том, чтобы пропускать влажный воздух через смесь крошечных частиц оксида железа и расплавленных химикатов (состоящих из гидроксидов натрия и калия), которые были поражены электричеством.
Решение Лихта состояло в том, чтобы пропускать влажный воздух через смесь крошечных частиц оксида железа и расплавленных химикатов (состоящих из гидроксидов натрия и калия), которые были поражены электричеством.
Любая химическая реакция представляет собой обмен электронами между атомами. В этом случае эти электроны необходимы, чтобы отделить водород от воды, а затем соединиться с азотом. «При подаче электричества оксид железа захватывает электроны, позволяя воде и воздуху напрямую реагировать с образованием аммиака», — сказал Лихт.
Утверждается, что этот метод использует только две трети энергии процесса Габера-Боша. Наряду с устранением необходимости производить водород из природного газа общие выбросы снижаются довольно значительно. Весь процесс также происходит в более мягких условиях, не требующих температуры 450°C и давления, в 200 раз превышающего атмосферное, как в процессе Габера-Боша.
Это не все, что делает метод Лихта привлекательным. Часть энергии поступает с помощью другой технологии, разработанной Лихтом, которая называется солнечным термоэлектрохимическим производством или STEP. Он считается одним из самых эффективных солнечных элементов, используемых в настоящее время. STEP при производстве аммиака приводит к производству водорода в качестве побочного продукта.
Он считается одним из самых эффективных солнечных элементов, используемых в настоящее время. STEP при производстве аммиака приводит к производству водорода в качестве побочного продукта.
Этот побочный продукт подходит для водородных топливных элементов, еще одного популярного направления для энтузиастов чистой энергии, по словам Дэвида Фермина, профессора электрохимии Бристольского университета. «Водород, полученный таким образом, значительно чище», — сказал он.
Однако одно дело — демонстрировать успех химического производства в лабораториях, и совсем другое — воспроизвести его в промышленных масштабах. Лихт признает, что есть возможности для улучшения, но он уверен, что это сработает. У Фермина есть предостережение, чтобы добавить: «Прежде чем переходить к полномасштабному масштабированию, потребуется лучшее понимание механизма этой сложной реакции переноса нескольких электронов».
Но даже с методом Лихта, отмечает Фермин, мы далеки от того, чтобы воспроизвести естественную эффективность преобразования азота из воздуха в полезные химические вещества, что делают азотфиксирующие бактерии. «Что действительно примечательно, так это то, что природа делает это невероятно эффективно при низких температурах», — добавил Фермин.
«Что действительно примечательно, так это то, что природа делает это невероятно эффективно при низких температурах», — добавил Фермин.
И все же, если что-то более эффективное сможет заменить процесс Габера-Боша, это снизит энергозатраты на производство одного из самых важных химических веществ в мире и приведет к заметному сокращению глобальных выбросов CO 2 выбросы.
Дополнительная информация:
«Синтез аммиака с помощью N2 и паровой электролиз в суспензиях расплавленных гидроксидов наноразмерного Fe2O3», S. Licht et al. Наука, www.sciencemag.org/lookup/doi/… 1126/science.1254234
Источник:
Разговор
Эта история опубликована с разрешения The Conversation (под лицензией Creative Commons-Attribution/Без производных).
Цитата :
Вода и воздух — это все, что вам нужно для производства аммиака — одного из важнейших химических веществ в мире (8 августа 2014 г.)
получено 19 ноября 2022 г.