Содержание
Технология биосинтеза кормового L-Треонина
ПРЕДСТАВЛЕНИЕ ПРОДУКТА
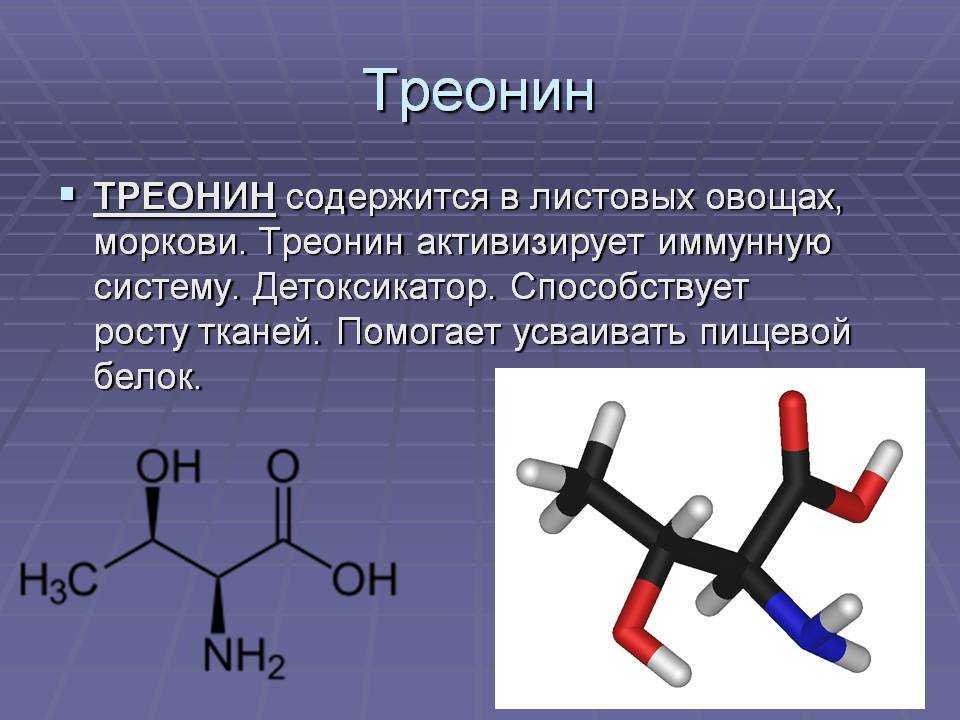
L-threonine
В данной технологии продуцентом является штамм Escherichia coli.
ФОРМУЛА И МОЛЕКУЛЯРНЫЙ ВЕС
СПЕЦИФИКАЦИЯ КОНЕЧНОГО ПРОДУКТА
Threonine фармацевтической очистки:
- Описание: белый кристаллический порошок
- Чистота: ≥99%
- pH (25 g/L): 5.0÷6.5
- потери при сушке: ≤0.5%
Threonine кормовая чистота:
Чистота: ≥98%
РЫНОК
- Объем 80.000 тонн/год (2004), рост рынка ~10% в год.
- Основные производители:
- U.S.A.: ADM
- Europe: Biosphere (I), BASF (D)
- Asia: Ajinomoto, Kyowa Hakko (Jap)
ПАТЕНТЫ
Закончились.
ТЕХНОЛОГИЯ
Конечная концентрация: 75±5 g/L
Время ферментации: 40±5 hrs
Выход на стадии выделения ≥70% фармацевтическая чистота
≥85% кормовая чистота (стандарт: 90%)
Конверсия сахара в продукт: ≥32%
ПРОЦЕСС
Описание процесса биосинтеза:
Производственный процесс начинается с этапа колб, затем следует засев посевного ферментера с геометрическим объемом 15 m3, рабочий объем: 10m3. Посевной материал из посевного ферментера переносится в промышленный аппарат с общим объемом: 160m3, начальный рабочий объем: 75m3. Перемешивание и аэрация измеряется и контролируется для поддержания оптимального уровня растворенного кислорода в среде. В процессе культивирование происходит подпитка свежим субстратом. После ферментации культуральная жидкость передается на стадию выделения и очистки.
Посевной материал из посевного ферментера переносится в промышленный аппарат с общим объемом: 160m3, начальный рабочий объем: 75m3. Перемешивание и аэрация измеряется и контролируется для поддержания оптимального уровня растворенного кислорода в среде. В процессе культивирование происходит подпитка свежим субстратом. После ферментации культуральная жидкость передается на стадию выделения и очистки.
СХЕМА ВЫДЕЛЕНИЯ
Культуральная жидкость |
↓ |
ультрафильтрация |
↓ |
сушка |
↓ |
концентрирование |
↓ |
обесцвечивание |
↓ |
кристаллизация |
↓ |
центрифугирование |
↓ |
Сушка (кормовая чистота) |
↓ |
Дополнительная очистка |
ПАРАМЕТРЫ ФЕРМЕНТАЦИИ
| Тип ферментации | batch + feed |
| время ферментации (ч) | 40±5 |
| время очистки (ч) | 12 |
| время цикла (ч) | 52±5 |
| объем ферментера (m3) | 160 |
| сливной объем (m3) | 120 |
| содержание продукта (kg) | 9,000 |
| финальная концентрация продукта (kg/ m3) | 75±5 |
выход на стадии выделения (фарм.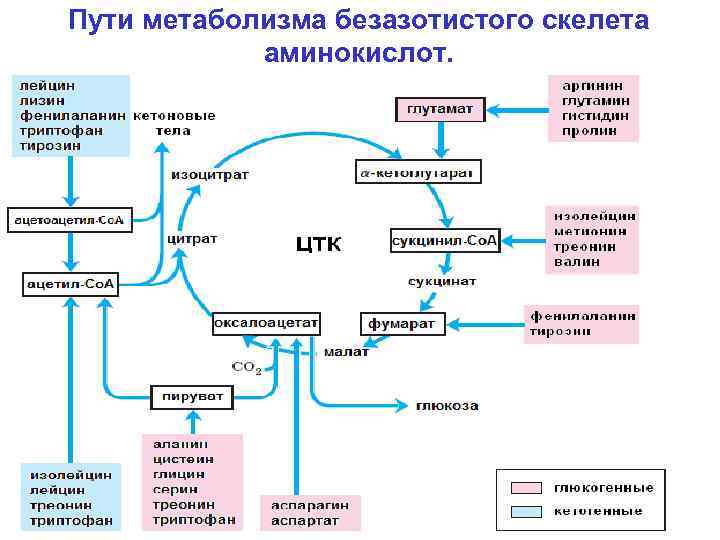 качество) качество) | ≥70% |
| выход на стадии выделения (корм. качество) | ≥85% |
| коэфициент конверсии сахара (%) | ≥32 |
| максимальная аэрация (VVM) | 1.5 |
| аэрация (kWh/kg продукта) | 2 |
| максимальная установленаая мощность (kW/m3) | 2.5÷3 |
| Энергия: перемешивание+охлаждение (kWh/kg продукта) | 2.1 |
| пар (kg/kg продукта) | 2.8 |
ОСНОВНЫЕ КОМПОНЕНТЫ СРЕДЫ
| KH2PO4 |
| (NH4)2SO4 |
| Citric acid |
| Salts |
| Corn Steep Atomized |
| KH2PO4 |
ВЫДЕЛЕНИЕ КРИСТАЛЛОВ, ОСНОВНЫЕ КОМПОНЕНТЫ
| Культуральная жидкость |
| Активированный уголь |
| NaHCO3 |
| H2SO4 |
| NaOH 20% |
| растворитель |
| HCl |
| Очищенная вода |
| NH4OH |
L-Треонин кормовой — добавка для обогащения кормов сельхозживотных и птиц
L-Треонин кормовой — добавка для обогащения и балансирования рационов сельскохозяйственных животных, в т. ч. птиц, приготовления полнорационных комбикормов, премиксов, кормовых добавок на комбикормовых заводах или кормоцехах.
ч. птиц, приготовления полнорационных комбикормов, премиксов, кормовых добавок на комбикормовых заводах или кормоцехах.
Состав и форма выпуска: L-Треонин представляет собой белый кристаллический порошок с содержанием активного вещества не менее 98,5 %. Препарат имеет низкое содержание пыли и летучих веществ.
Фармакологические свойства: Треонин, в первую очередь, служит структурным элементом более крупных молекул — от простых пептидов до очень сложных белков. Специалисты, занимающиеся кормлением животных, нередко уделяют основное внимание влиянию аминокислот на рост мышц и эффективность производства мясных продуктов. На самом деле, метаболическая роль треонина существенно шире, а именно: рост скелетной мускулатуры, синтез пищеварительных ферментов и иммунных белков (которые присутствуют в высоких концентрациях), синтез глицерина, получение энергии (через цикл трикарбоновых кислот). Желудочно-кишечный эпителий (клетки слизистой, слизь и пищеварительные ферменты) и некоторые иммунные белки особенно богаты треонином.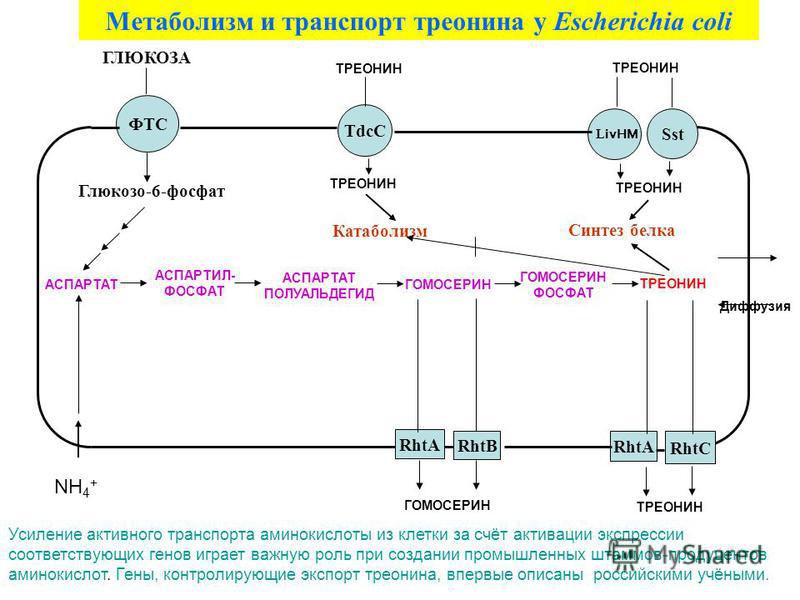 Эксперименты показали, что небольшой дефицит треонина гораздо сильнее влияет на синтез иммуноглобулина, чем на рост тела. Треонин является одним из нескольких возможных предшественников заменимой кислоты глицина, которая синтезируется организмом животных, и в этом смысле треонин играет определенную роль в регулировании усвоения пищи. Ключевыми ферментами метаболизма треонина у птиц и свиней являются, соответственно, треонинальдолаза и треониндегидрогеназа. Поскольку оба этих фермента катализируют необратимые реакции, глицин не может служить метаболическим источником треонина. Углеродный скелет треонина может послужить источником энергии, окисляясь в цикле лимонной кислоты, куда он вводится в виде пирувата.
Эксперименты показали, что небольшой дефицит треонина гораздо сильнее влияет на синтез иммуноглобулина, чем на рост тела. Треонин является одним из нескольких возможных предшественников заменимой кислоты глицина, которая синтезируется организмом животных, и в этом смысле треонин играет определенную роль в регулировании усвоения пищи. Ключевыми ферментами метаболизма треонина у птиц и свиней являются, соответственно, треонинальдолаза и треониндегидрогеназа. Поскольку оба этих фермента катализируют необратимые реакции, глицин не может служить метаболическим источником треонина. Углеродный скелет треонина может послужить источником энергии, окисляясь в цикле лимонной кислоты, куда он вводится в виде пирувата.
Показания: Многие виды зерновых и другие кормовые компоненты имеют низкое содержание треонина, для преодоления этого дефицита в них требуется добавлять треонин. Это особенно важно при балансировке рационов на основе пшеницы, ячменя и сорго. В этих видах зерна треонин часто оказывается второй лимитирующей аминокислотой.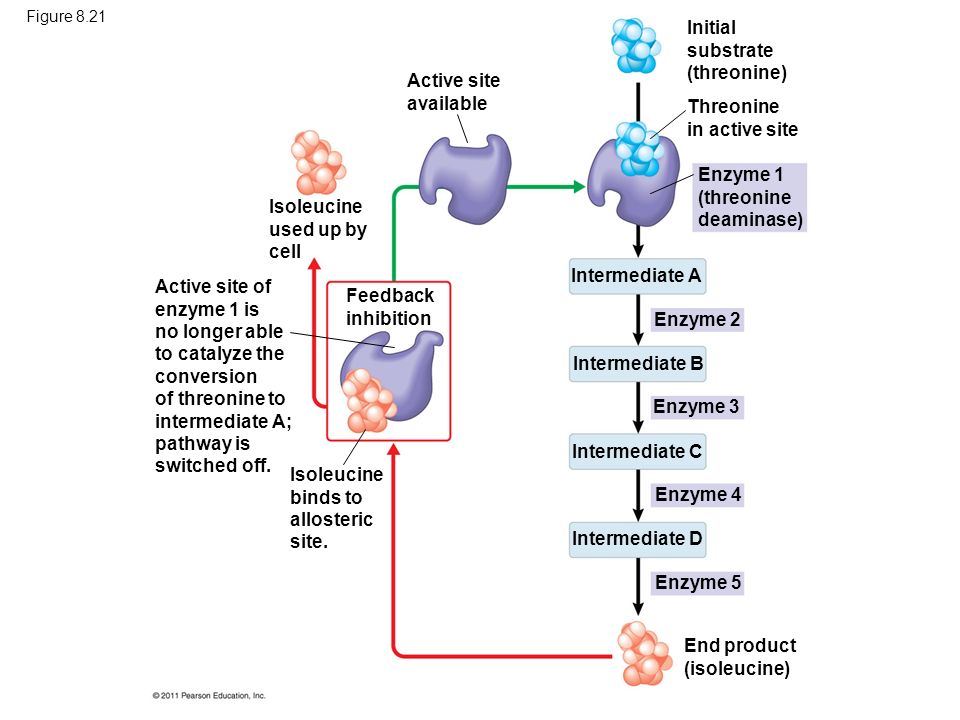 Кроме того, для свиней переваримость треонина в этих компонентах очень мала. Для свиней — первой лимитирующей аминокислотой является лизин и от содержания лизина в корме напрямую зависит мясная продуктивность. Второй аминокислотой, без которой невозможно добиться максимального использования кормовых ресурсов в свиноводстве, является треонин. Добавка чистых аминокислот в рацион свиней позволяет без снижения темпов роста уменьшить содержание протеина в корме и улучшить его использование. Общепризнанно, что если целевой задачей является минимальная жирность туши (максимальное содержание белка), потребность в аминокислотах оказывается выше, чем при задаче максимальной скорости или эффективности роста. В некоторых случаях отмечается тенденция к возрастанию жирности у свиней, получающих корм с пониженным содержанием белка и добавками аминокислот. В птицеводстве уделяется серьезное внимание задаче снижения уровня протеина в корме за счет введения концентрированных аминокислот, что обеспечивает оптимальное развитие ремонтного молодняка и максимальную яичную продуктивность у кур-несушек, и максимальный прирост живой массы и конверсию корма у бройлеров.
Кроме того, для свиней переваримость треонина в этих компонентах очень мала. Для свиней — первой лимитирующей аминокислотой является лизин и от содержания лизина в корме напрямую зависит мясная продуктивность. Второй аминокислотой, без которой невозможно добиться максимального использования кормовых ресурсов в свиноводстве, является треонин. Добавка чистых аминокислот в рацион свиней позволяет без снижения темпов роста уменьшить содержание протеина в корме и улучшить его использование. Общепризнанно, что если целевой задачей является минимальная жирность туши (максимальное содержание белка), потребность в аминокислотах оказывается выше, чем при задаче максимальной скорости или эффективности роста. В некоторых случаях отмечается тенденция к возрастанию жирности у свиней, получающих корм с пониженным содержанием белка и добавками аминокислот. В птицеводстве уделяется серьезное внимание задаче снижения уровня протеина в корме за счет введения концентрированных аминокислот, что обеспечивает оптимальное развитие ремонтного молодняка и максимальную яичную продуктивность у кур-несушек, и максимальный прирост живой массы и конверсию корма у бройлеров. Первой и второй лимитирующими аминокислотами в птицеводстве являются метионин и лизин. Включение треонина в корма для бройлеров и несушек, уже содержащие добавки метионина и лизина, является также эффективным особенно на начальных этапах роста.
Первой и второй лимитирующими аминокислотами в птицеводстве являются метионин и лизин. Включение треонина в корма для бройлеров и несушек, уже содержащие добавки метионина и лизина, является также эффективным особенно на начальных этапах роста.
Дозы и способ применения: Препарат вносят в комбикорма, премиксы и кормовые добавки на комбикормовых заводах или кормоцехах хозяйств. Количество вводимого L-Треонина в комбикорма зависит от вида и возраста сельскохозяйственных животных, в т. ч. птиц и определяется в соответствии с Нормами, утвержденными Минсельхозпродом России 30 апреля 1997 года Об использовании биологически активных веществ (БАВ) и нормы их ввода в комбикорма.
Побочные действия не наблюдаются. Противопоказания не установлены.
Особые указания: При выгрузке, складировании и загрузке L-Треонина кормового необходимо соблюдать общепринятые меры безопасности, предусмотренные для работы с химикатами. При возможном попадании материала на кожу или в глаза необходимо использовать средства защиты (резиновые или пластиковые перчатки, защитные очки). Перед перерывом в работе и по ее окончании следует вымыть руки и лицо. При попадании препарата в глаза следует промыть их большим количеством воды.
Перед перерывом в работе и по ее окончании следует вымыть руки и лицо. При попадании препарата в глаза следует промыть их большим количеством воды.
Фасовка: Мешки по 25 кг из бумаги и полиэтилена, Биг Бэги по 500 — 1000 кг из полипропилена.
Условия хранения: В упаковке производителя в сухом, защищенном от света помещении при температуре до 30 °С. Срок годности препарата — 5 лет.
Производитель: Ningxia EPPEN Biotech Co.,ltd, Китай.
для свиней
для бройлеров
для несушек
- Подробности
- Просмотров: 5091
Вперёд
Улучшенное производство L-треонина в Escherichia coli с использованием системы каркасов ДНК
1.
Икеда М.
2003.
Процессы получения аминокислот. Доп. Биохим. англ. Биотехнолог.
79:1–35 [PubMed] [Google Scholar]
2.
Ридс П.Дж.
2000.
Незаменимые и незаменимые аминокислоты для человека. Дж. Нутр.
130:1835S–1840S [PubMed] [Google Scholar]
3.
Гийуэ С., Родал А.А., Ан Г., Лессар П.А., Сински А.Дж.
1999.
Экспрессия катаболической треониндегидратазы Escherichia coli в Corynebacterium glutamicum и ее влияние на продукцию изолейцина. заявл. Окружающая среда. микробиол.
65:3100–3107 [бесплатная статья PMC] [PubMed] [Google Scholar]
4.
Guilluet S, Rodal AA, An GH, Gorret N, Lessard PA, Sinskey AJ.
2001.
Метаболическое перенаправление потока углерода в сторону изолейцина за счет экспрессии катаболической треониндегидратазы в продуцирующей треонин Corynebacterium glutamicum. заявл. микробиол. Биотехнолог.
57:667–673 [PubMed] [Google Scholar]
5.
Икеда М., Кацумата Р.
1992.
Метаболическая инженерия для производства тирозина или фенилаланина в штамме Corynebacterium glutamicum, продуцирующем триптофан. заявл. Окружающая среда. микробиол.
58:781–785 [бесплатная статья PMC] [PubMed] [Google Scholar]
6.
Икеда М., Наканиши К., Кино К., Кацумата Р.
1994.
Ферментативная продукция триптофана стабильным рекомбинантным штаммом Corynebacterium glutamicum с модифицированным серин-биосинтетическим путем. Бионауч. Биотехнолог. Биохим.
58:674–678 [PubMed] [Google Scholar]
7.
Икеда М., Одзаки А., Кацумата Р.
1993.
Производство фенилаланина метаболически сконструированными Corynebacterium glutamicum с геном pheA Escherichia coli. заявл. микробиол. Биотехнолог.
39:318–323 [PubMed] [Google Scholar]
8.
Lee KH, Park JH, Kim TY, Kim HU, Lee SY.
2007.
Системная метаболическая инженерия Escherichia coli для продукции L-треонина. Мол. Сист. биол.
3:149. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9.
Ли С.И., Пак Дж.Х.
2010.
Интеграция системной биологии с инженерией биопроцессов: производство l-треонина системной метаболической инженерией Escherichia coli. Доп. Биохим. англ. Биотехнолог.
120:1–19 [PubMed] [Google Scholar]
10.
Пак Дж. Х., Чан Й. С., Ли Дж. В., Ли СИ.
2011.
Escherichia coli W в качестве нового штамма платформы для усиленного производства l-валина с помощью системной метаболической инженерии. Биотехнолог. биоинж.
108:1140–1147 [PubMed] [Google Scholar]
11.
Пак Дж.Х., Ли С.И.
2010.
Метаболические пути и ферментативное производство аминокислот семейства L-аспартатов. Биотехнолог. Дж.
5:560–577 [PubMed] [Google Scholar]
12.
Тиноко И.
2002.
Физическая химия: принципы и приложения в биологических науках, 4-е изд.
Prentice Hall, Upper Saddle River, NJ [Google Scholar]
13.
Роу А.Дж., О’Бирн С., Маклагган Д., Бут И.Р.
2002.
Ингибирование роста кишечной палочки уксусной кислотой: проблема биосинтеза метионина и токсичность гомоцистеина. микробиология
148:2215–2222 [PubMed] [Google Scholar]
14.
Конрадо Р.Дж., Варнер Д.Д., ДеЛиза М.П.
2008.
Разработка пространственной организации метаболических ферментов: имитация синергии природы. Курс. мнение Биотехнолог.
19:492–499 [PubMed] [Google Scholar]
15.
Башор С.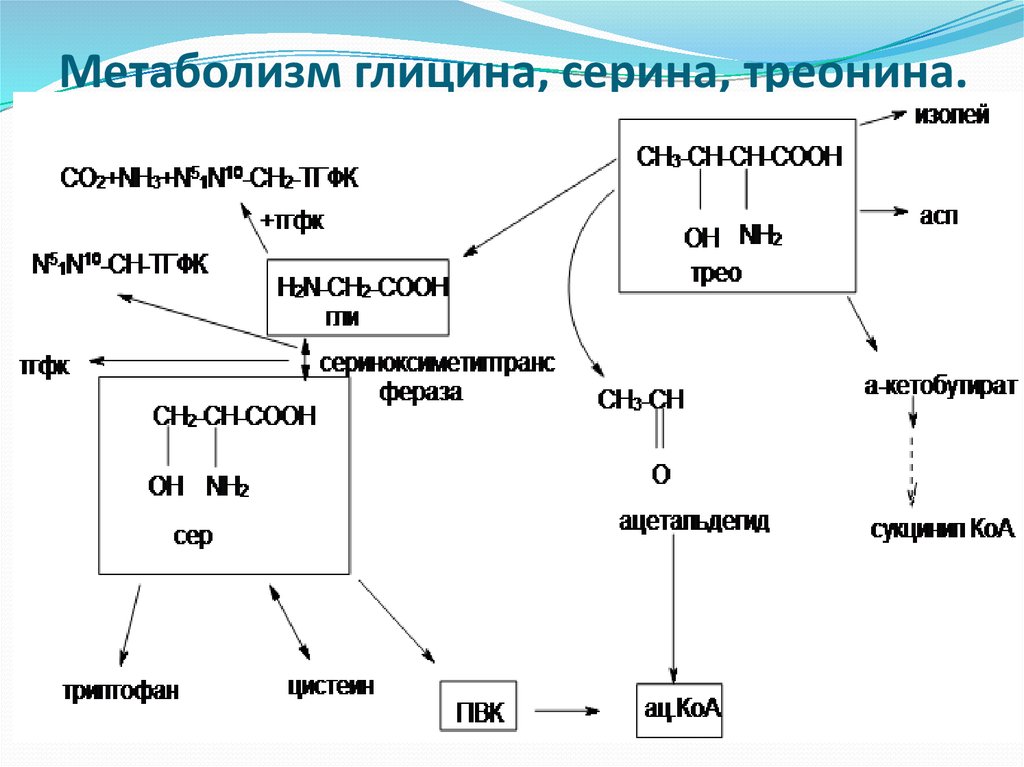 Дж., Хорвиц А.А., Пейсайович С.Г., Лим В.А.
Дж., Хорвиц А.А., Пейсайович С.Г., Лим В.А.
2010.
Перепрошивка клеток: синтетическая биология как инструмент для изучения принципов организации живых систем. Анну. Преподобный Биофиз.
39:515–537 [бесплатная статья PMC] [PubMed] [Google Scholar]
16.
Блузар Дж. К., Коутиньо П. М., Фиробе Х. П., Хенриссат Б., Линьон С., Тардиф К., Пейдж С., де Филип П.
2010.
Модуляция состава целлюлозы у Clostridium cellulolyticum: адаптация к полисахаридной среде, выявленная протеомным анализом и анализом углеводно-активных ферментов. протеомика
10:541–554 [PubMed] [Google Scholar]
17.
Бомбл Й.Дж., Бекхэм Г.Т., Мэтьюз Дж.Ф., Нимлос М.Р., Химмель М.Э., Кроули М.Ф.
2011.
Моделирование самосборки целлюлозосомного ферментного комплекса. Дж. Биол. хим.
286:5614–5623 [бесплатная статья PMC] [PubMed] [Google Scholar]
18.
Дюбер Дж.Э., Ву Г.К., Мальмирчегини Г.Р., Мун Т.С., Петцольд С.Дж., Уллал А.В., Пратер К.Л., Кислинг Д.Д.
2009.
Синтетические белковые каркасы обеспечивают модульный контроль над метаболическим потоком. Нац. Биотехнолог.
Нац. Биотехнолог.
27:753–759 [PubMed] [Google Scholar]
19.
Хороший MC, Zalatan JG, Lim WA.
2011.
Каркасные белки: узлы для управления потоком клеточной информации. Наука
332:680–686 [бесплатная статья PMC] [PubMed] [Google Scholar]
20.
Лим В.А.
2010.
Разработка индивидуальных цепей сигнализации сотовой связи. Нац. Преподобный Мол. Клеточная биол.
11:393–403 [бесплатная статья PMC] [PubMed] [Google Scholar]
21.
Мицузава С., Кагава Х., Ли И., Чан С.Л., Паавола К.Д., Трент Д.Д.
2009.
Розеттазим: синтетическая целлюлоза. Дж. Биотехнология.
143:139–144 [PubMed] [Google Scholar]
22.
Нордон Р.Э., Крейг С.Дж., Фунг Ф.К.
2009.
Молекулярная инженерия целлюлосомного комплекса для применения в аффинити и биоэнергетике. Биотехнолог. лат.
31:465–476 [PubMed] [Google Scholar]
23.
Пейсайович С.Г., Гарбарино Дж.Е., Вэй П., Лим В.А.
2010.
Быстрая диверсификация фенотипов передачи сигналов клеток за счет рекомбинации модульных доменов. Наука
328:368–372 [бесплатная статья PMC] [PubMed] [Google Scholar]
24.
Янив О., Шимон Л.Дж., Байер Э.А., Ламед Р., Фролов Ф.
2011.
Модуль связывания углеводов семейства 3b, связанный с скаффолдином, из целлюлосомы Bacteroides cellulosolvens: структурное разнообразие и значение кальция для связывания углеводов. Акта Кристаллогр. Д биол. Кристаллогр.
67: 506–515 [PubMed] [Google Scholar]
25.
Зик А., Лукач М., Лим В.А., Ременьи А.
2009.
Каркасы: интерактивные платформы для сотовых сигнальных цепей. Тенденции клеточной биологии.
19:364–374 [бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Делебек С.Дж., Линднер А.Б., Сильвер П.А., Алдай Ф.А.
2011.
Организация внутриклеточных реакций с помощью рационально сконструированных ансамблей РНК. Наука
333:470–474 [PubMed] [Google Scholar]
27.
Конрадо Р.Дж., Ву Г.К., Бук Дж.Т., Сюй Х., Чен С.Ю., Лебар Т., Турнсек Дж., Томшич Н., Авбель М., Габер Р., Копривняк Т., Мори Дж., Главник В., Вовк И., Бенчина М., Ходник В., Андерлух Г. , Дьюбер Дж. Э., Джерала Р., Делиса М.П.
2012.
Направляемая ДНК сборка путей биосинтеза способствует повышению каталитической эффективности.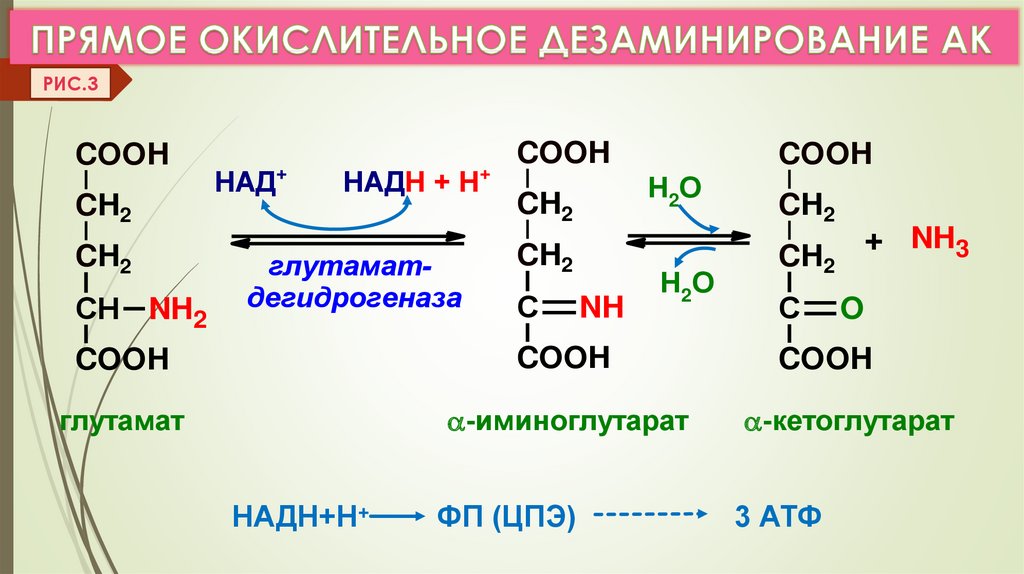 Нуклеиновые Кислоты Res.
Нуклеиновые Кислоты Res.
40:1879–1889 [бесплатная статья PMC] [PubMed] [Google Scholar]
28.
Блаттнер Ф.Р., Планкетт Г., III, Блох К.А., Перна Н.Т., Бурланд В., Райли М., Колладо-Видес Дж., Гласнер Д.Д., Роде К.К., Мэйхью Г.Ф., Грегор Дж., Дэвис Н.В., Киркпатрик Х.А., Геден М.А., Роуз Д.Дж., Мау Б, Шао Ю.
1997.
Полная последовательность генома Escherichia coli K-12. Наука
277:1453–1462 [PubMed] [Google Scholar]
29.
Шио И., Накамори С., Сано К.
май
1971.
Ферментативное производство L-треонина. Патент США 3 580 810
30.
Lee JH, Sung BH, Kim MS, Blattner FR, Yoon BH, Kim JH, Kim SC.
2009 г..
Метаболическая инженерия штамма Escherichia coli с уменьшенным геномом для производства L-треонина. микроб. Сотовый факт.
8:2
doi:10.1186/1475-2859-8-2 [бесплатная статья PMC] [PubMed] [Google Scholar]
31.
Lee JY, Sung BH, Yu BJ, Lee JH, Lee SH, Kim MS, Koob MD, Kim SC.
2008.
Фенотипическая инженерия путем перепрограммирования транскрипции генов с использованием новых искусственных факторов транскрипции в Escherichia coli.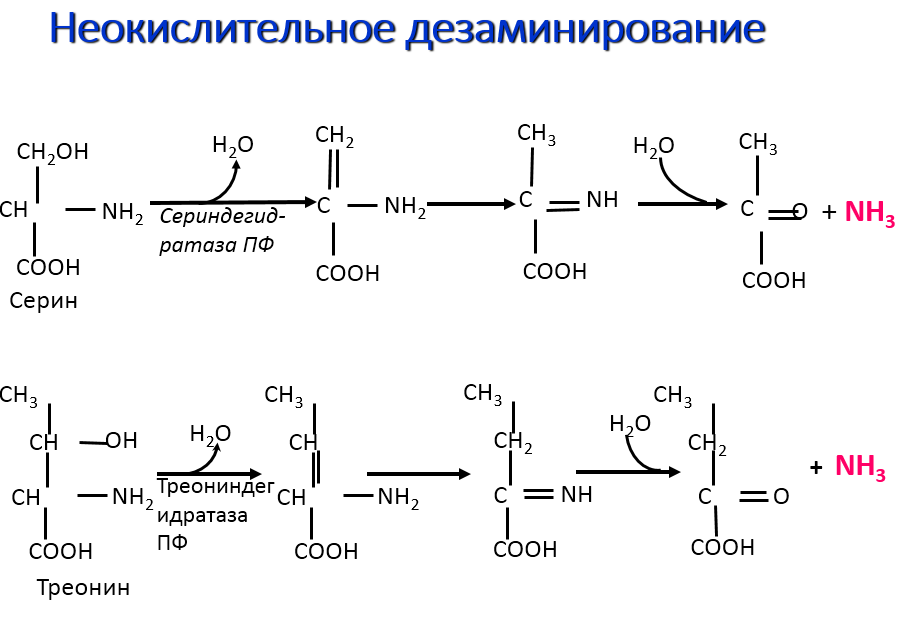 Нуклеиновые Кислоты Res.
Нуклеиновые Кислоты Res.
36:е102
doi:10.1093/nar/gkn449 [бесплатная статья PMC] [PubMed] [Google Scholar]
32.
Щесюль М., Вамплер Д.Э.
1976 год.
Регуляция метаболической системы in vitro: синтез треонина из аспарагиновой кислоты. Биохимия
15:2236–2244 [PubMed] [Google Scholar]
33.
Chassagnole C, Rais B, Quentin E, Fell DA, Mazat JP.
2001.
Комплексное исследование кинетики ферментов треонинового пути в Escherichia coli. Биохим. Дж.
356:415–423 [бесплатная статья PMC] [PubMed] [Google Scholar]
34.
Вамплер DE, Вестхед EW.
1968 год.
Две аспартокиназы из Escherichia coli. Характер торможения и молекулярных изменений, сопровождающих обратимую инактивацию. Биохимия
7:1661–1671 [PubMed] [Google Scholar]
35.
Чжо А., Маунг Великобритания, Тое Т.
1985.
Определение неорганического фосфата с молибдатом и Тритоном Х-100 без восстановления. Анальный. Биохим.
145:230–234 [PubMed] [Google Scholar]
36.
Джозеф М.Х., Марсден, Калифорния.
1986 год.
Аминокислоты и малые пептиды, стр. 13–28
13–28
В
Лим СК. (ред.), ВЭЖХ малых молекул, практический подход.
IRL Press, Оксфорд, Великобритания [Google Scholar]
37.
Bae KH, Kwon YD, Shin HC, Hwang MS, Ryu EH, Park KS, Yang HY, Lee DK, Lee Y, Park J, Kwon HS, Kim HW, Yeh BI, Lee HW, Sohn SH, Yoon J, Seol W , Ким Дж.С.
2003.
Цинковые пальцы человека как строительные блоки при создании искусственных факторов транскрипции. Нац. Биотехнолог.
21:275–280 [PubMed] [Google Scholar]
38.
Пак К.С., Ли Д.К., Ли Х., Ли И., Чан И.С., Ким Ю.Х., Ян ХИ, Ли Си, Соль В., Ким Дж.С.
2003.
Фенотипическое изменение эукариотических клеток с использованием рандомизированных библиотек искусственных факторов транскрипции. Нац. Биотехнолог.
21:1208–1214 [PubMed] [Google Scholar]
39.
Далл’Аква В., Саймон А.Л., Малкеррин М.Г., Картер П.
1998.
Вклад остатков интерфейса домена в стабильность гомодимеров домена Ch4 антитела. Биохимия
37:9266–9273 [PubMed] [Google Scholar]
40.
Нейдхардт ФК, Кертисс Р.
1996.
Escherichia coli и Salmonella: клеточная и молекулярная биология, 2-е изд.
ASM Press, Вашингтон, округ Колумбия [Google Scholar]
41.
Shames SL, Ash DE, Wedler FC, Villafranca JJ.
1984.
Взаимодействие аспартата и антиметаболитов аспартата с ферментами пути биосинтеза треонина кишечной палочки. Дж. Биол. хим.
259:15331–15339 [PubMed] [Google Scholar]
42.
Шамес С.Л., Ведлер ФК.
1984.
Гомосеринкиназа Escherichia coli: кинетический механизм и ингибирование полуальдегидом L-аспартата. Арка Биохим. Биофиз.
235:359–370 [PubMed] [Google Scholar]
43.
Ведлер ФК, Лей Б.В.
1993.
Кинетические и регуляторные механизмы гомосериндегидрогеназы-I (Escherichia coli). Кинетика равновесного изотопного обмена. Дж. Биол. хим.
268:4880–4888 [PubMed] [Google Scholar]
44.
Котре А.М., Салливан С.Дж., Саважо М.А.
1973.
Метаболическая регуляция гомосерином в Escherichia coli B-r. Дж. Бактериол.
116:663–672 [бесплатная статья PMC] [PubMed] [Google Scholar]
45.
Исида М., Кавасима Х., Сато К., Хасигучи К., Ито Х., Эней Х., Накамори С.
1994.
Факторы, улучшающие продукцию L-треонина рекомбинантным штаммом Brevibacterium lactofermentum, амплифицированным тремя генами биосинтеза L-треонина. Бионауч. Биотехнолог. Биохим.
Бионауч. Биотехнолог. Биохим.
58:768–770 [PubMed] [Google Scholar]
46.
Исида М., Сато К., Хасигучи К., Ито Х., Эней Х., Накамори С.
1993.
Высокоферментативная продукция L-треонина из ацетата стабилизированным штаммом Brevibacterium flavum, трансформированным рекомбинантной плазмидой, несущей оперон Escherichia coli thr. Бионауч. Биотехнолог. Биохим.
57:1755–1756 [PubMed] [Google Scholar]
47.
Круз Д., Крамер Р., Эггелинг Л., Рипинг М., Пфефферле В., Чиу Дж. Х., Чанг Ю. Дж., Младший, Сайер М. Х., Бурковски А.
2002.
Влияние экспортеров треонина на продукцию треонина в Escherichia coli. заявл. микробиол. Биотехнолог.
59:205–210 [PubMed] [Google Scholar]
48.
Пак Дж.Х., Ли С.И.
2010.
Ферментативное производство аминокислот с разветвленной цепью: акцент на метаболической инженерии. заявл. микробиол. Биотехнолог.
85:491–506 [PubMed] [Google Scholar]
49.
Пак Дж.Х., Ли С.И.
2008.
К системной метаболической инженерии микроорганизмов для производства аминокислот. Курс. мнение Биотехнолог.
Курс. мнение Биотехнолог.
19:454–460 [PubMed] [Google Scholar]
50.
Hong SH, Kim JS, Lee SY, In YH, Choi SS, Rih JK, Kim CH, Jeong H, Hur CG, Kim JJ.
2004.
Последовательность генома капнофильной бактерии рубца Mannheimia succiniciproducens. Нац. Биотехнолог.
22:1275–1281 [PubMed] [Google Scholar]
51.
Бхаттачарья Р.П., Ременьи А., Йех Б.Дж., Лим В.А.
2006.
Домены, мотивы и каркасы: роль модульных взаимодействий в эволюции и проводке клеточных сигнальных цепей. Анну. Преподобный Биохим.
75:655–680 [PubMed] [Google Scholar]
52.
Дюбер Дж. Э., Йе Б. Дж., Чак К., Лим В. А.
2003.
Перепрограммирование управления аллостерическим сигнальным переключателем посредством модульной рекомбинации. Наука
301:1904–1908 [PubMed] [Google Scholar]
53.
Феррелл Дж. Э., младший, Симприх К.А.
2003.
Вынужденная близость в функции известного эшафота. Мол. Клетка
11:289–291 [PubMed] [Google Scholar]
54.
Фонтес CM, Гилберт HJ.
2010.
Целлюлосомы: высокоэффективные наномашины, предназначенные для разрушения сложных углеводов растительной клеточной стенки. Анну. Преподобный Биохим.
Анну. Преподобный Биохим.
79:655–681 [PubMed] [Google Scholar]
55.
Гилберт ХДж.
2007.
Целлюлосомы: микробные наномашины, демонстрирующие пластичность четвертичной структуры. Мол. микробиол.
63:1568–1576 [PubMed] [Google Scholar]
56.
Гулдер Т.А., Фримен М.Ф., Пил Дж.
1
Маршировать
2011.
Каталитическое разнообразие мультимодульных поликетидсинтаз: биосинтез натуральных продуктов вне правил сборки учебников. Вершина. Курс. хим. [Epub перед печатью.] doi:10.1007/128_2010_113 [PubMed] [Google Scholar]
57.
Кван Д.Х., Шульц Ф.
2011.
Стереохимия сложного биосинтеза поликетидов модульными поликетидсинтазами. Молекулы
16:6092–6115 [бесплатная статья PMC] [PubMed] [Google Scholar]
58.
Лим В.А.
2002.
Модульная логика сигнальных белков: построение аллостерических переключателей из простых связывающих доменов. Курс. мнение Структура биол.
12:61–68 [PubMed] [Google Scholar]
59.
Майер Т., Лейбундгут М., Берингер Д., Бан Н.
2010.
Структура и функция эукариотических синтаз жирных кислот. Q. Преподобный Биофиз.
Q. Преподобный Биофиз.
43:373–422 [PubMed] [Google Scholar]
60.
Пер А., Смит С.П., Байер Э.А., Ламед Р., Боровок И.
2009.
Нецеллюлосомные когезиновые и докериноподобные модули в трех областях жизни. ФЭМС микробиол. лат.
291:1–16 [бесплатная статья PMC] [PubMed] [Google Scholar]
61.
Бхакта М.С., Сигал Д.Дж.
2010.
Генерация белков цинковых пальцев методом модульной сборки. Методы Мол. биол.
649:3–30 [бесплатная статья PMC] [PubMed] [Google Scholar]
62.
Иманиши М., Накамура А., Морисаки Т., Футаки С.
2009.
Положительная и отрицательная кооперативность модульно собранных цинковых пальцев. Биохим. Биофиз. Рез. коммун.
387:440–443 [PubMed] [Google Scholar]
63.
Янц Д., Берг Дж.М.
2010.
Исследование ДНК-связывающей аффинности и специфичности сконструированных белков цинковых пальцев. Биофиз. Дж.
98:852–860 [бесплатная статья PMC] [PubMed] [Google Scholar]
64.
Тезе Дж., Клейдман Л., Сент-Жиронс И.
1974.
Гомосеринкиназа из Escherichia coli K-12: свойства, ингибирование l-треонином и регуляция биосинтеза. Дж. Бактериол.
Дж. Бактериол.
118:577–581 [бесплатная статья PMC] [PubMed] [Google Scholar]
65.
Вудгейт Дж., Палфри Д., Нагель Д.А., Хайн А.В., Слейтер Н.К.
2002.
Белково-опосредованное выделение плазмидной ДНК с помощью аффинного линкера цинковый палец-глутатион-S-трансфераза. Биотехнолог. биоинж.
79:450–456 [PubMed] [Google Scholar]
66.
Дежарле Дж. Р., Берг Дж. М.
1993.
Использование консенсусной последовательности цинковых пальцев и правил специфичности для разработки специфических ДНК-связывающих белков. проц. Натл. акад. науч. США.
90:2256–2260 [бесплатная статья PMC] [PubMed] [Google Scholar]
67.
Медер С.И., Хинк М.А., Кинхабвала А., Майр Р., Бастианс П.И., Кноп М.
2007.
Пространственная регуляция активности киназы Fus3 MAP посредством механизма реакции-диффузии в передаче сигналов феромонов дрожжей. Нац. Клеточная биол.
9:1319–1326 [PubMed] [Google Scholar]
68.
Слотер Б.Д., Шварц Дж.В., Ли Р.
2007.
Картирование динамических белковых взаимодействий в передаче сигналов киназы MAP с использованием спектроскопии флуктуаций флуоресценции живых клеток и визуализации.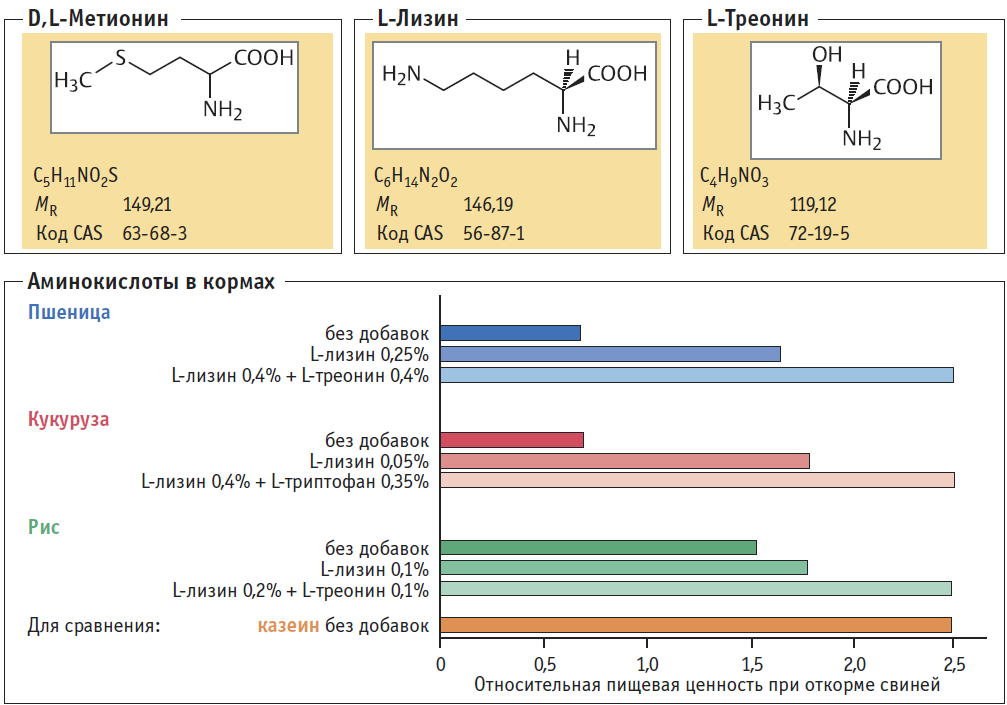 проц. Натл. акад. науч. США.
проц. Натл. акад. науч. США.
104:20320–20325 [бесплатная статья PMC] [PubMed] [Google Scholar]
69.
Фишер Х, Поликарпов И, Крайевич АФ.
2004.
Средняя плотность белка является функцией, зависящей от молекулярной массы. Белковая наука.
13:2825–2828 [бесплатная статья PMC] [PubMed] [Google Scholar]
T 2272/09 (производство L-треонина/EVONIK DEGUSSA) от 11.09.2013
| Идентификатор европейской судебной практики: | ЭКЛИ:ЭП:БА:2013:Т227209.20130911 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Дата принятия решения: | 11 сентября 2013 г. | ||||||||
| Номер дела: | Т 2272/09 | ||||||||
| Номер заявки: | 03708150.2 | ||||||||
| Класс IPC: | Ц12П 13/04 Ц12П 13/08 Ц12Н 1/21 Ц12Н 15/11 Ц12Н 15/60 | ||||||||
| Язык разбирательства: | ЕН | ||||||||
| Распределение: | Д | ||||||||
| Загрузка и дополнительная информация: |
| ||||||||
| Название заявки: | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ ШТАММОВ СЕМЕЙСТВА ENTEROBACTERIACEAE | ||||||||
| Имя заявителя: | Эвоник Дегусса ГмбХ | ||||||||
| Имя соперника: | — | ||||||||
| Доска: | 3. 3.02 3.02 | ||||||||
| Заголовок: | — | ||||||||
| Соответствующие правовые положения: | |||||||||
| Ключевые слова: | Претензии — ясность Претензии — основной запрос (нет) Претензии — ясность Претензии — вспомогательный запрос (нет) | ||||||||
| Ключевые слова: | — | ||||||||
| Процитированные решения: | |||||||||
| Со ссылкой на решения: | |||||||||
Краткое изложение фактов и доводов
I. Апелляция основывается на решении отдела экспертизы, вынесенном 12 мая 2009 г. и опубликованном 10 июля 2009 г., в котором заявка на европейский патент была отклонена на основании статьи 97(2) ЭПК.
II. Экспертное подразделение решило, что основной запрос не был новизной по сравнению с документами (1) (Allison et al. 1998, Biochem. J. 256: 741-749).), (2) (Nemeria et al. 1999, FASEB Journal 13: A1349) и (3) (Schulze et al.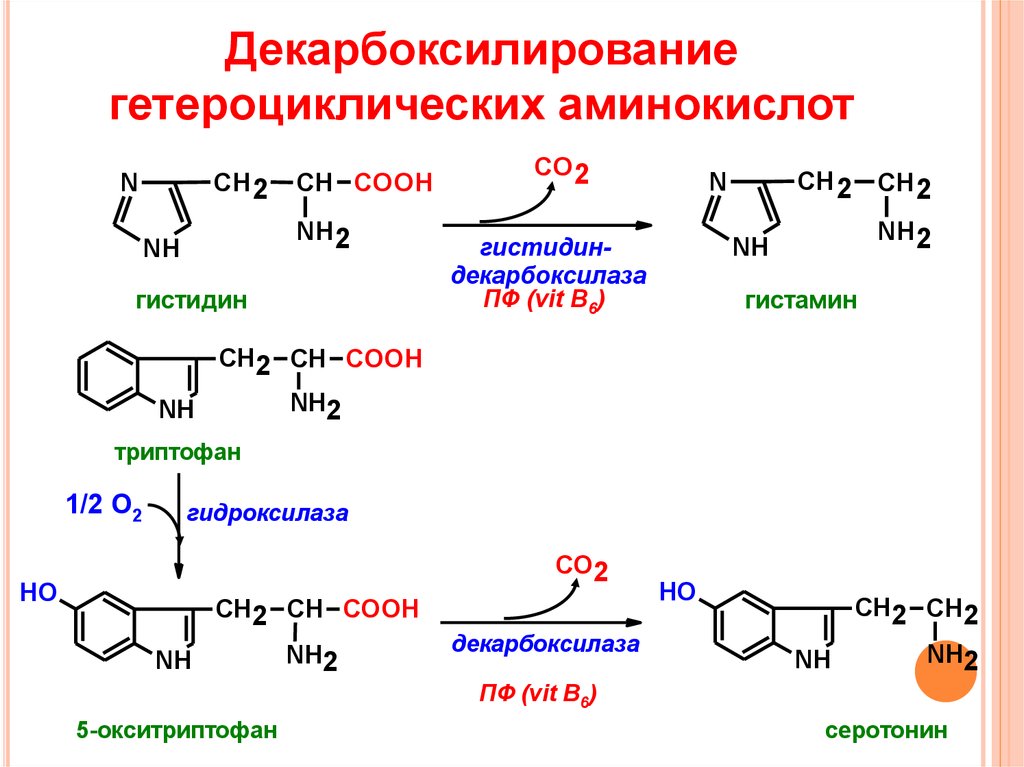 1992, Biochimica et Biophysica Acta 1120: 87-96) и что дополнительный запрос не отвечал требованиям Статьи 84, 83 и 56 ЕПК.
1992, Biochimica et Biophysica Acta 1120: 87-96) и что дополнительный запрос не отвечал требованиям Статьи 84, 83 и 56 ЕПК.
III. Заявитель, который является подателем апелляции, подал апелляцию на решение отдела экспертизы с просьбой отменить это решение и выдать патент в соответствии с ходатайством об основной формуле изобретения, которое было рассмотрено отделом экспертизы. Вместе с изложением оснований апелляции были подшиты документы с А1 по А6.
IV. В ответ на приглашение к устному разбирательству в апелляционной коллегии заявитель повторно представил в качестве основного ходатайства требования основного ходатайства, на которых основывалось оспариваемое решение, и подал вспомогательное ходатайство.
Пункты 1 и 6 основного запроса гласят:
«1. Способ производства L-треонина, отличающийся тем, что осуществляют следующие стадии:
а) ферментацию микроорганизмов семейства Enterobacteriaceae, которые продуцируют L-треонин, в котором сверхэкспрессируется один или несколько генов, выбранных из группы, состоящей из lpd, aceE и aceF, и аллелей генов, которые являются результатом вырождения генетического кода, при этом сверхэкспрессия достигается в микроорганизмах, которые уже продуцируют L-треонин,
б) обогащение L-треонином среды или клеток микроорганизмов и
в) выделение L-треонина.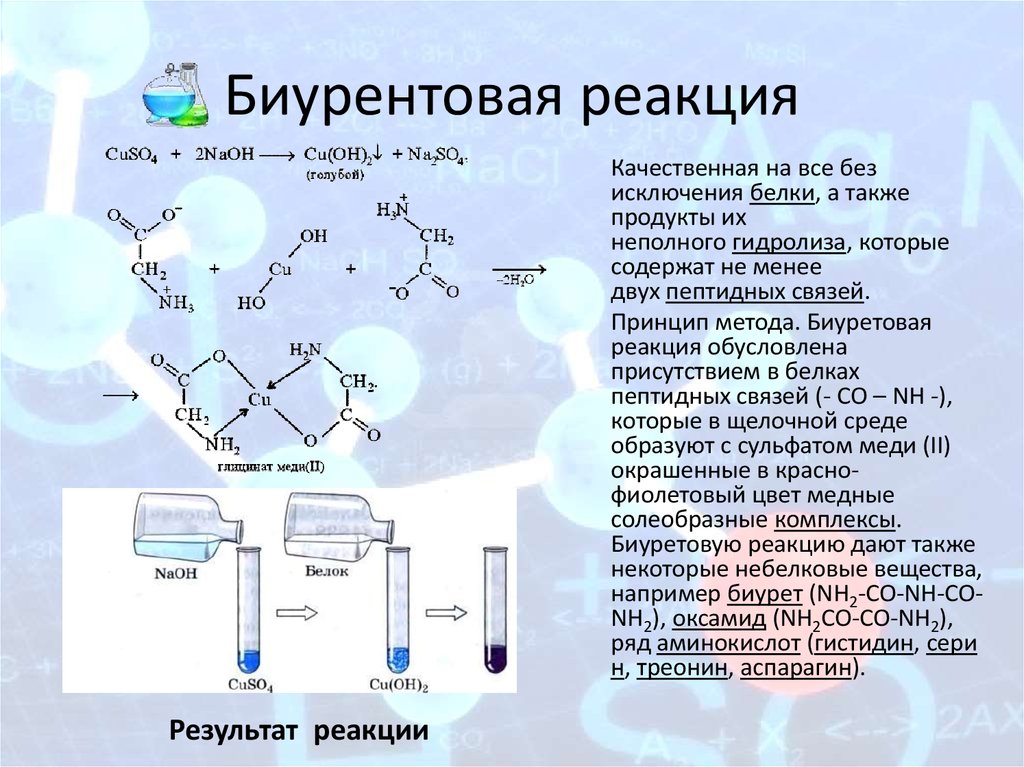 »
»
«6. L-треонин-продуцирующие микроорганизмы семейства Enterobacteriaceae, особенно рода Escherichia, у которых один или несколько генов выбраны из группы, состоящей из lpd, aceE и aceF, и аллелей генов, которые являются результатом вырождения генетического кода или мутации нейтрального смысла присутствуют в сверхэкспрессированной форме, посредством чего сверхэкспрессия достигается в микроорганизмах, которые уже продуцируют L-треонин».0003
Вспомогательный запрос отличается от основного тем, что пункт 6 удален.
V. Устное разбирательство состоялось 11 сентября 2013 года. В ходе устного разбирательства были рассмотрены основные и дополнительные требования. Заявитель не хотел подавать дополнительные запросы.
VI. В этом решении цитируются следующие документы:
(A1) Mateos et al. 1987, мол. Генерал Жене. 206: 361-367 (первая страница)
(A2) Miwa et al. 1983, с/х. биол. хим. 47: 2329-2334 (первая страница)
(A3) Sugita et al. 1987, Gene 57: 151-158 (страницы 151 и 152)
(A4) Debakov 2003, Достижения в области биохимической инженерии 79: 113-136
(A5) Schlegel 1992, Allgemeine Mikrobiologie 7-е издание; стр.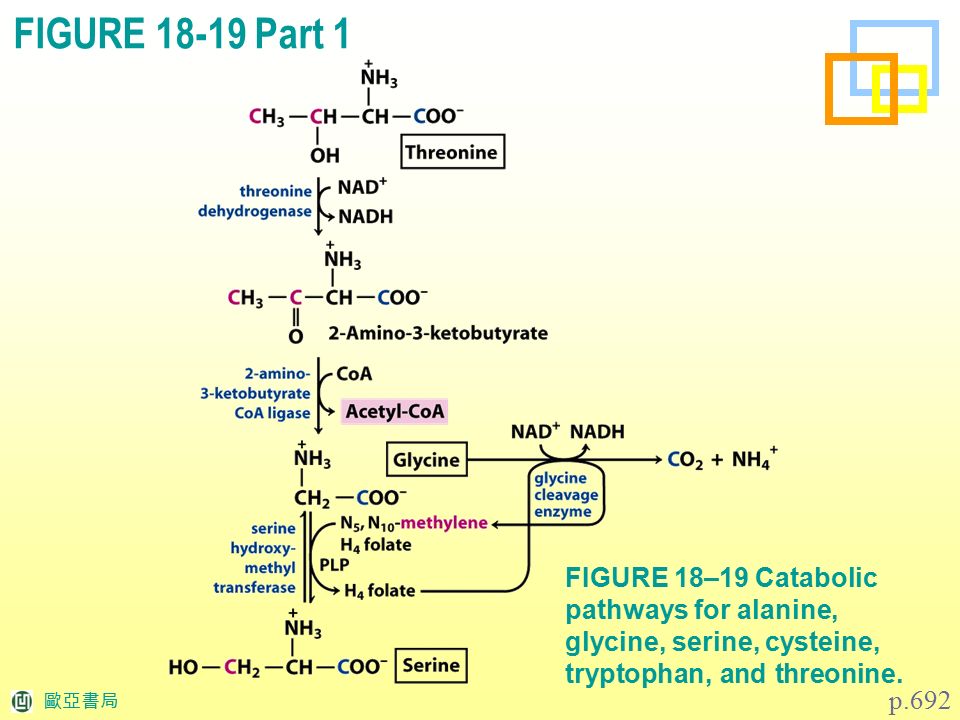 274, 275, 358-361
274, 275, 358-361
VII. Доводы истца, относящиеся к настоящему решению, можно резюмировать следующим образом:
Функциональная особенность «микроорганизм, который уже вырабатывает L-треонин» была ясна квалифицированному специалисту, который мог бы отличить L- треонин, который образуется в результате биосинтеза и образования L-треонина. Это различие было также очевидно в документах A1 (стр. 361, Введение, первое предложение; и правая колонка, 4-й абзац, первое предложение), A2 (стр. 2329)., левый столбец, первое предложение и строки с 9 по 10), A3 (стр. 151, правый столбец, первое предложение; и стр. 152, левый столбец, первый абзац), A4 (рис. 1 на стр. 115; стр. 114, раздел 2.1; стр. 120, раздел 4. «Создание продуцентов L-треонина» и стр. 121, первый абзац, последние строки), и А5 (стр. 274, раздел 7.6; и стр. 359, раздел 10.3), где также проводится различие между биосинтезом L-треонина. треонин и конструирование штаммов-продуцентов L-треонина. Для получения штаммов, продуцирующих L-треонин, штаммы дикого типа подвергали мутагенезу, а полученные мутанты затем тестировали на продукцию L-треонина.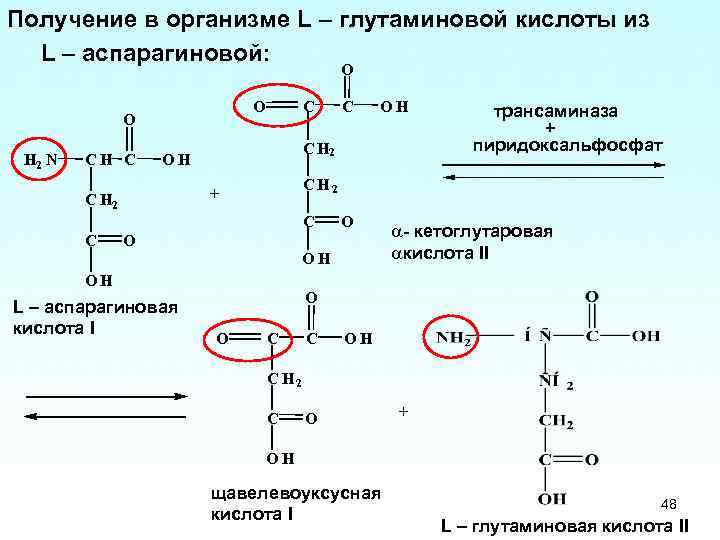 Так как изобретение было направлено на промышленное производство L-треонина, специалист в данной области будет рассматривать только те штаммы, которые продуцируют L-треонин, поскольку способ требует получения продукта. Экспериментальные данные, представленные в ходе разбирательства в первой инстанции, также показали, что не все штаммы Enterobacteriaceae продуцируют L-треонин.
Так как изобретение было направлено на промышленное производство L-треонина, специалист в данной области будет рассматривать только те штаммы, которые продуцируют L-треонин, поскольку способ требует получения продукта. Экспериментальные данные, представленные в ходе разбирательства в первой инстанции, также показали, что не все штаммы Enterobacteriaceae продуцируют L-треонин.
VIII. Апеллянт просит отменить решение экспертного отдела и выдать патент на основании основного заявления или дополнительного заявления, поданных вместе с письмом от 9 августа 2013 г.
Основания для решения
1. Апелляция приемлема.
Основной запрос – Статья 84 ЕПК
2. Статья 84 ЕПК требует, чтобы формула изобретения содержала определение предмета, в отношении которого испрашивается охрана, а также должна быть ясной и краткой и поддерживаться описанием.
3. В обжалованном решении экспертное подразделение сочло, что признаку «микроорганизм, который уже производит L-треонин» не хватает ясности, поскольку он не имеет стандартного и точного значения.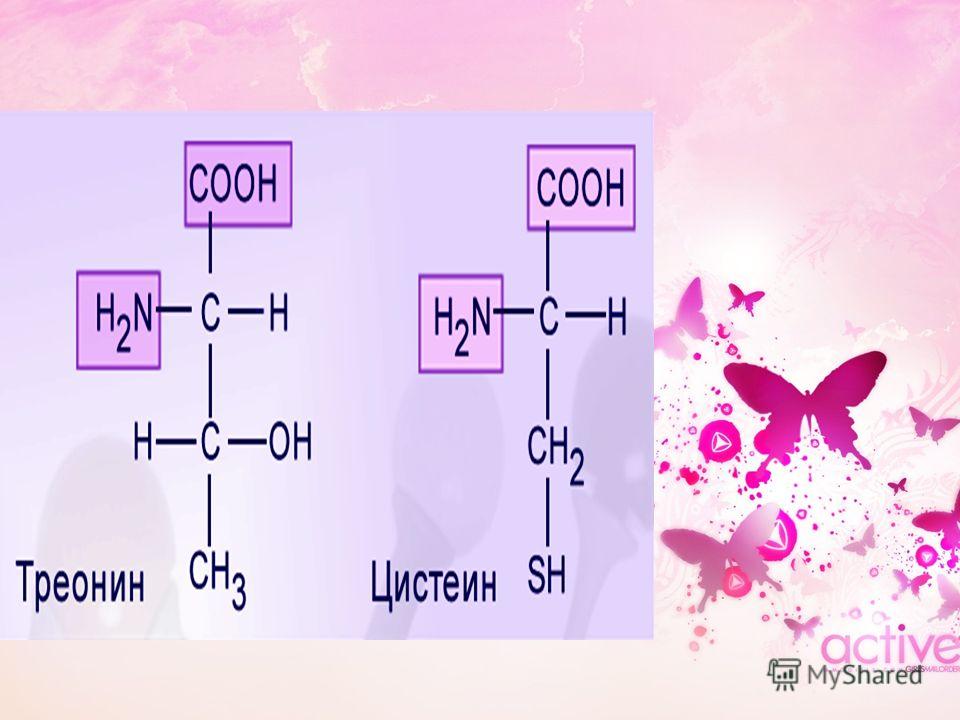
4. Заявитель утверждал, что специалист сможет отличить микроорганизмы, которые продуцируют L-треонин в рамках своего биосинтеза и исключительно для собственного использования, от тех микроорганизмов, которые могут быть использованы в качестве продуцентов L-треонина: только эти последние подпадали бы под группу, определяемую функциональным признаком «микроорганизм, который уже продуцирует L-треонин». Таким образом, эта особенность позволила бы четко различать продукцию и биосинтез аминокислот.
5. Правление не может использовать этот аргумент. Нигде в заявке нет конкретного определения вышеупомянутого признака «микроорганизм, который уже продуцирует L-треонин». Обычное значение термина «производство» в контексте веществ, эндогенно вырабатываемых организмом, не делает различия между производством для собственного метаболизма организма и производством для любой другой цели; он также не позволяет провести различие между низким и высоким производством: организм либо производит данное вещество, либо не производит его. Следовательно, эту характеристику следует понимать как относящуюся к любым микроорганизмам, которые продуцируют/синтезируют L-треонин, будь то в контексте простого биосинтеза аминокислот или в любом другом контексте.
Следовательно, эту характеристику следует понимать как относящуюся к любым микроорганизмам, которые продуцируют/синтезируют L-треонин, будь то в контексте простого биосинтеза аминокислот или в любом другом контексте.
6. В поддержку своего аргумента заявитель сослался на документы с А1 по А5. Согласно заявителю, все эти документы ясно показали, что существует различие между биосинтезом и производством аминокислот. Обозначения «конструкция штаммов, сверхпродуцирующих аминокислоты» (A1, правая колонка, строки 29–30), «мутанты, продуцирующие треонин», и «улучшенные штаммы, продуцирующие L-треонин» (A2, левая колонка, строки 9 и 10 и строка 21). , «штаммы-продуценты треонина» (A3, стр. 152, левый столбец, строка 5; A4, стр. 121, строки 11 и 12) и «продуценты L-треонина» (A4, стр. 120, строка 31) относятся к штаммам, в которых Повышается продукция L-треонина: такие штаммы, в отличие от штаммов дикого типа, могут быть использованы для промышленного производства L-треонина. Ясно, что это штаммы, которые квалифицированный специалист мог бы рассмотреть в контексте изобретения, поскольку использование других штаммов не привело бы к получению продукта.
7. Практикой апелляционных палат установлено, что квалифицированное лицо при рассмотрении претензии должно исключать толкования, которые нелогичны или не имеют технического смысла. Однако данная судебная практика не требует более узкого толкования широкого, но технически значимого термина в соответствии с субъективным пониманием заявителя. В данном случае обсуждаемый признак включает в себя термин «продуцировать», а не «перепроизводить»: все, что требуется, — это продукция L-треонина, а не избыточная продукция L-треонина или усиленная/повышенная продукция L-треонина. Даже если в вышеупомянутом предшествующем уровне техники эти термины могли использоваться как взаимозаменяемые, в заявке нет ничего, что подтверждало бы, что широкий термин «производство» следует ограничивать в толковании более узким термином «перепроизводство».
8. В этом отношении следует отметить, что документы с A1 по A5 (см. выше) также не дают стандартного определения этого термина: вместо этого они подтверждают общее знание о том, что L-треонин вырабатывается в результате биосинтеза аминокислот. В соответствии с этими документами усиление продукции L-треонина может быть достигнуто путем манипулирования указанным биосинтетическим путем, т.е. за счет сверхэкспрессии генов, которые непосредственно участвуют в биосинтезе треонина, или за счет мутации генов, что приводит к уменьшению ингибирования L-треонином по типу обратной связи. Однако неясно, как объективно идентифицировать подходящие штаммы, которые «(избыточно) продуцируют» L-треонин: какие количества/концентрации L-треонина должны продуцироваться, чтобы данный штамм принадлежал к группе подходящих штаммов. ?
В соответствии с этими документами усиление продукции L-треонина может быть достигнуто путем манипулирования указанным биосинтетическим путем, т.е. за счет сверхэкспрессии генов, которые непосредственно участвуют в биосинтезе треонина, или за счет мутации генов, что приводит к уменьшению ингибирования L-треонином по типу обратной связи. Однако неясно, как объективно идентифицировать подходящие штаммы, которые «(избыточно) продуцируют» L-треонин: какие количества/концентрации L-треонина должны продуцироваться, чтобы данный штамм принадлежал к группе подходящих штаммов. ?
Правление соглашается, что специалист в данной области в большинстве случаев сможет установить, продуцирует ли данный микроорганизм L-треонин в количествах, достаточных для использования в процессах промышленного производства аминокислот. Однако это не то, что утверждается. Чтобы четко определить предмет формулы изобретения, необходимо знать, каков нижний предел продукции L-треонина, необходимый для того, чтобы штамм подпадал под объем формулы изобретения, но этот нижний предел не определяется ни приложением или известным уровнем техники.
9. Апеллянт также утверждал, что не все штаммы Enterobacteriaceae продуцируют L-треонин, как показали экспериментальные данные, представленные в ходе разбирательства в суде первой инстанции: как таковые, действительно было возможно различить штаммы, продуцирующие L-треонин. из тех, кто этого не сделал. Этот аргумент снова направлен на различие между биосинтезом L-треонина, который регулярно происходит в микроорганизмах, и перепроизводством L-треонина. Действительно, вышеупомянутые экспериментальные данные измеряли L-треонин, присутствующий в ферментационном бульоне, а не L-треонин, присутствующий в клетках микроорганизмов: как таковой, это может подтвердить отсутствие перепроизводства L-треонина, но не отсутствие какого-либо производства L-треонина. вообще. Таким образом, этот аргумент также не убеждает правление.
10. По этим причинам комиссия пришла к выводу, что пункты 1 и 6 основного запроса не дают четкого определения предмета, для которого испрашивается охрана, поскольку они не обеспечивают точных различий, ограничивающих объем формулы изобретения.
