Содержание
Технология биосинтеза кормового L-Треонина
ПРЕДСТАВЛЕНИЕ ПРОДУКТА
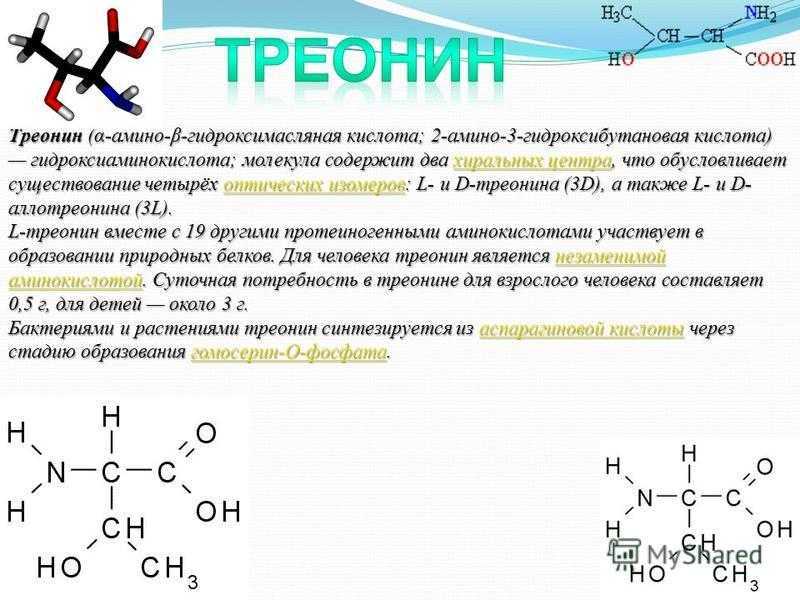
L-threonine
В данной технологии продуцентом является штамм Escherichia coli.
ФОРМУЛА И МОЛЕКУЛЯРНЫЙ ВЕС
СПЕЦИФИКАЦИЯ КОНЕЧНОГО ПРОДУКТА
Threonine фармацевтической очистки:
- Описание: белый кристаллический порошок
- Чистота: ≥99%
- pH (25 g/L): 5.0÷6.5
- потери при сушке: ≤0.5%
Threonine кормовая чистота:
Чистота: ≥98%
РЫНОК
- Объем 80.000 тонн/год (2004), рост рынка ~10% в год.
- Основные производители:
- U.S.A.: ADM
- Europe: Biosphere (I), BASF (D)
- Asia: Ajinomoto, Kyowa Hakko (Jap)
ПАТЕНТЫ
Закончились.
ТЕХНОЛОГИЯ
Конечная концентрация: 75±5 g/L
Время ферментации: 40±5 hrs
Выход на стадии выделения ≥70% фармацевтическая чистота
≥85% кормовая чистота (стандарт: 90%)
Конверсия сахара в продукт: ≥32%
ПРОЦЕСС
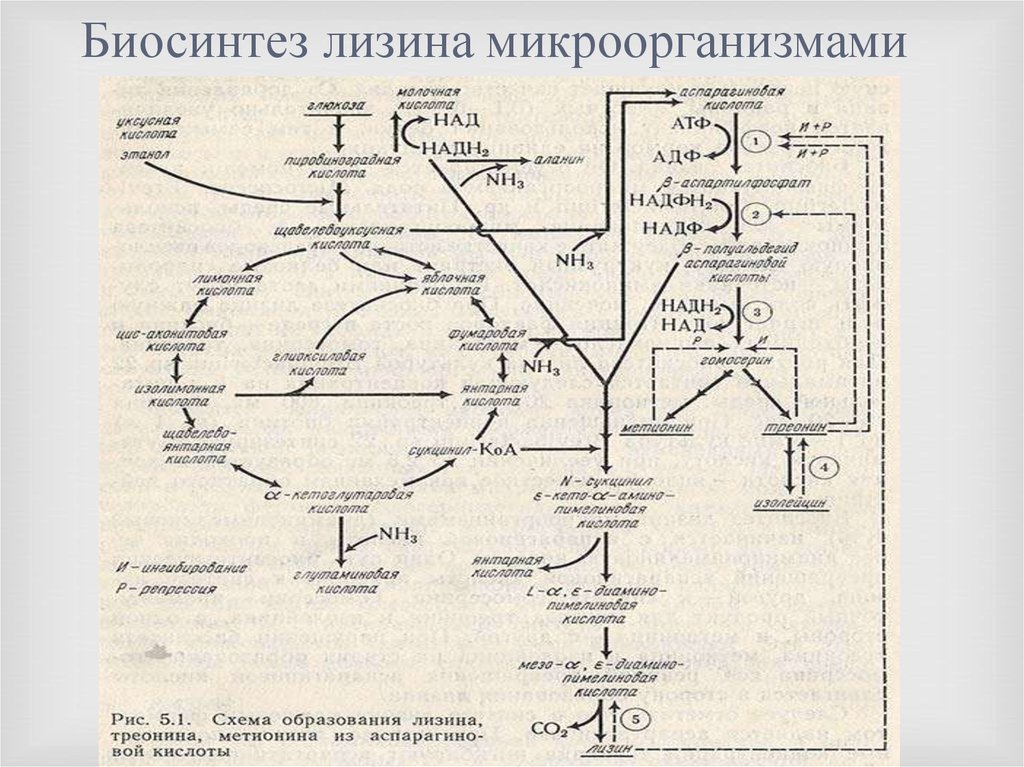
Описание процесса биосинтеза:
Производственный процесс начинается с этапа колб, затем следует засев посевного ферментера с геометрическим объемом 15 m3, рабочий объем: 10m3. Посевной материал из посевного ферментера переносится в промышленный аппарат с общим объемом: 160m3, начальный рабочий объем: 75m3. Перемешивание и аэрация измеряется и контролируется для поддержания оптимального уровня растворенного кислорода в среде. В процессе культивирование происходит подпитка свежим субстратом. После ферментации культуральная жидкость передается на стадию выделения и очистки.
Посевной материал из посевного ферментера переносится в промышленный аппарат с общим объемом: 160m3, начальный рабочий объем: 75m3. Перемешивание и аэрация измеряется и контролируется для поддержания оптимального уровня растворенного кислорода в среде. В процессе культивирование происходит подпитка свежим субстратом. После ферментации культуральная жидкость передается на стадию выделения и очистки.
СХЕМА ВЫДЕЛЕНИЯ
Культуральная жидкость |
↓ |
ультрафильтрация |
↓ |
сушка |
↓ |
концентрирование |
↓ |
обесцвечивание |
↓ |
кристаллизация |
↓ |
центрифугирование |
↓ |
Сушка (кормовая чистота) |
↓ |
Дополнительная очистка |
ПАРАМЕТРЫ ФЕРМЕНТАЦИИ
| Тип ферментации | batch + feed |
| время ферментации (ч) | 40±5 |
| время очистки (ч) | 12 |
| время цикла (ч) | 52±5 |
| объем ферментера (m3) | 160 |
| сливной объем (m3) | 120 |
| содержание продукта (kg) | 9,000 |
| финальная концентрация продукта (kg/ m3) | 75±5 |
выход на стадии выделения (фарм. качество) качество) | ≥70% |
| выход на стадии выделения (корм. качество) | ≥85% |
| коэфициент конверсии сахара (%) | ≥32 |
| максимальная аэрация (VVM) | 1.5 |
| аэрация (kWh/kg продукта) | 2 |
| максимальная установленаая мощность (kW/m3) | 2.5÷3 |
| Энергия: перемешивание+охлаждение (kWh/kg продукта) | 2.1 |
| пар (kg/kg продукта) | 2.8 |
ОСНОВНЫЕ КОМПОНЕНТЫ СРЕДЫ
| KH2PO4 |
| (NH4)2SO4 |
| Citric acid |
| Salts |
| Corn Steep Atomized |
| KH2PO4 |
ВЫДЕЛЕНИЕ КРИСТАЛЛОВ, ОСНОВНЫЕ КОМПОНЕНТЫ
| Культуральная жидкость |
| Активированный уголь |
| NaHCO3 |
| H2SO4 |
| NaOH 20% |
| растворитель |
| HCl |
| Очищенная вода |
| NH4OH |
Импорт китайского метионина в РФ вырос в пять раз
Объем импорта китайского метионина по итогам первых шести месяцев 2022 года увеличился в 5 раз по сравнению с таким же периодом 2021-го, до 3 тыс.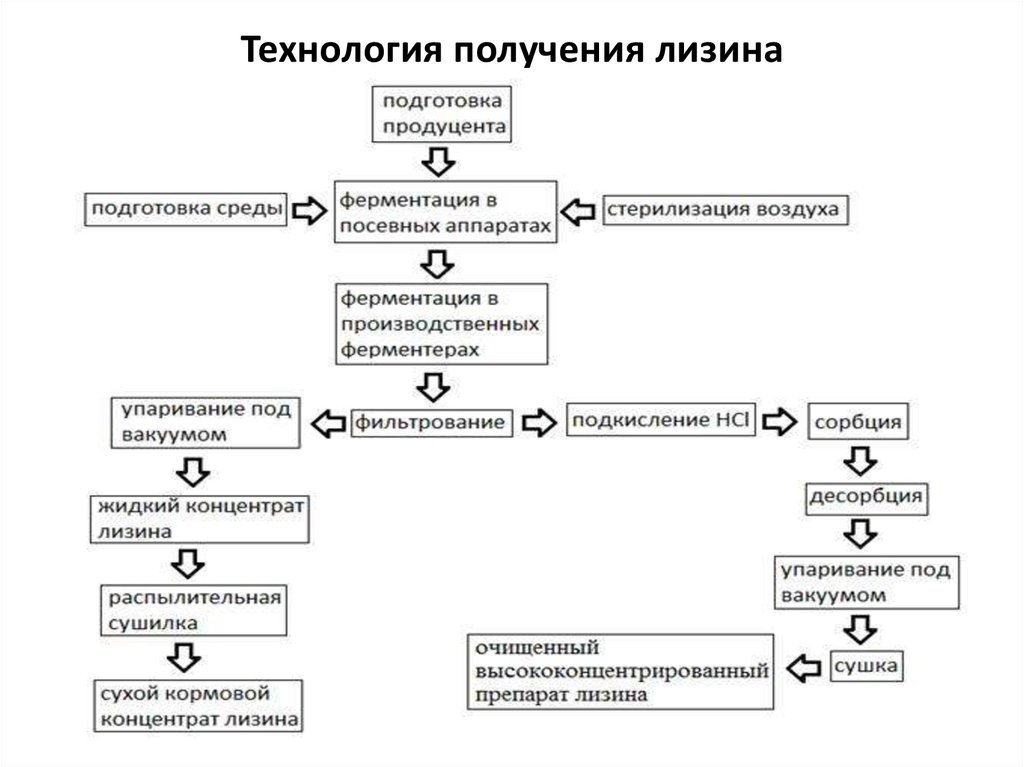 тонн, следует из обзора информационно-аналитического агентства FEEDLOT, посвященного анализу поставок импортных кормовых компонентов в Россию.
тонн, следует из обзора информационно-аналитического агентства FEEDLOT, посвященного анализу поставок импортных кормовых компонентов в Россию.
В целом, по оценкам экспертов, структура поставок кормовых аминокислот и витаминов с января по июнь 2022-го года изменилась в пользу Китая и других стран Азии. Аналитики уточнили, что сейчас основной поставщик кормовых добавок в Россию – это Китай.
Объемы поставок из Китая
Так, треонин в Россию поставляется только китайского производства. По итогам первого полугодия в Россию завезли 21 тыс. тонн китайского треонина по средней контрактной цене 1,8 евро/кг.
Импорт другой кормовой аминокислоты – триптофана за шесть месяцев 2022 года увеличился на 73% (914 тонн) по сравнению с январем – июнем 2021 года.
«На 30% возросли и объемы поставок лизина моногидрохлорида, почти до 30 тыс. тонн, при этом его контрактная цена увеличилась на 62%. Практически весь объем поставок лизин сульфата 70% также осуществляется из Китая: было ввезено почти 9 тыс.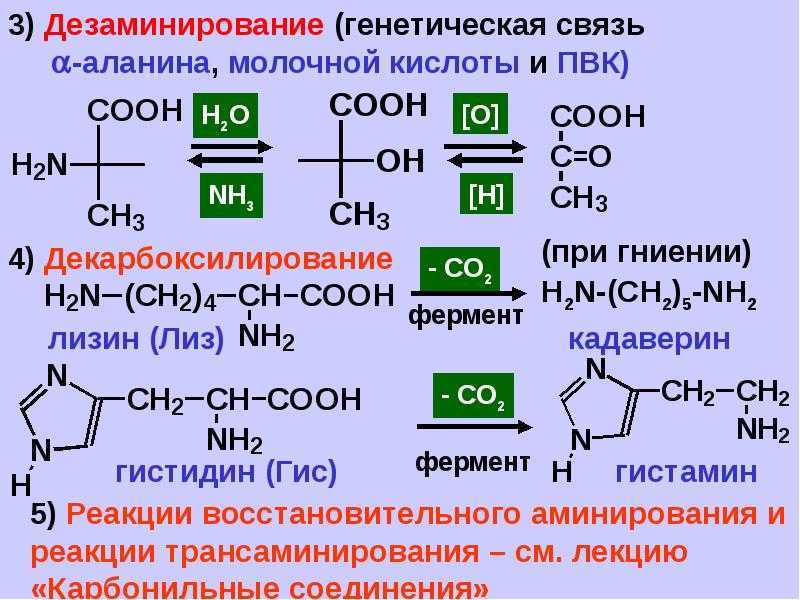 тонн, средняя контрактная цена увеличилась до 1,3 евро/кг», – сообщили эксперты агентства FEEDLOT.
тонн, средняя контрактная цена увеличилась до 1,3 евро/кг», – сообщили эксперты агентства FEEDLOT.
По их оценкам, наблюдается также рост объема поставок из КНР валина и бетаина.
А вот отгрузки ряда витаминов из Китая показали отрицательную динамику.
«Объем поставок витамина D3 из Китая в Россию составил 33 тыс. тонн, что на 70% меньше, чем в прошлом году», – сообщили аналитики. Также снизился объем импорта витамина В2 до уровня 39 тонн, что на 39% ниже показателей аналогичного периода предыдущего года.
Незначительно снизились поставки китайского витамина А1000.
А вот поставки витамина В1 увеличились на 55%, отгрузки В6 выросли на 31%, поставки витамина В3 сохранились на уровне предыдущего года.
Поставки кормовых компонентов из других стран
В январе – июне 2022 года из Малайзии в Россию ввозился только метионин. Объем поставок увеличился на 80% относительно аналогичного периода 2021 года и составил 623 тонны.
Из Индонезии импортировали 244 тонны триптофана, что ниже прошлогодних объемов на 47%.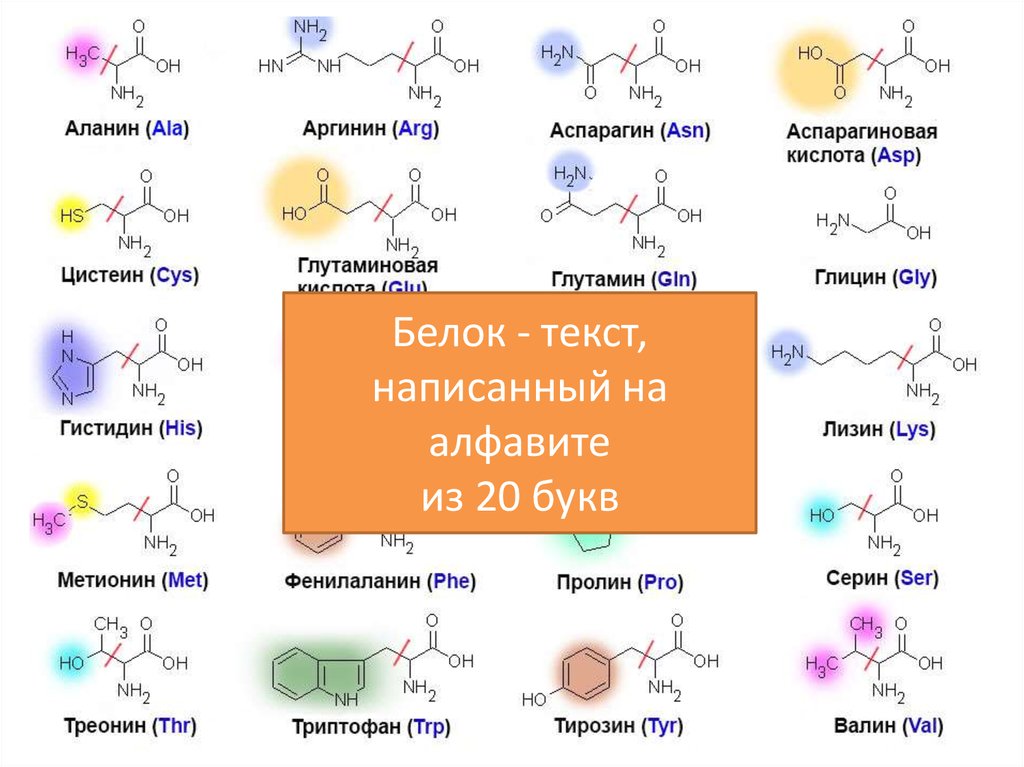
Из Республики Корея за январь – июнь 2022 года импортировали 189 тонн триптофана, что в 4 раза выше показателей предыдущего года, с мая поставки были прекращены.
Из Бразилии в Россию поставляли моногидрохлорид. По итогам первого полугодия 2022-го поставки снизились на 16% по сравнению с таким же периодом 2021-го и составили 1,8 тыс. тонн. Причем в июне лизин Бразилия не импортировала.
Из Японии поставляли незначительные объемы метионина. За первые полгода 2022-го ввезли 1 тыс. тонн, что ниже аналогичного периода 2021 года на 62%. Начиная с мая поставки прекратились.
Импорт из Европы
Что касается импорта из Европы, то один из крупных поставщиков кормовых компонентов в Россию – это Бельгия.
В период с января по июнь 2022 года из Бельгии ввезли 6,4 тыс. тонн метионина, в основном производства компании EVONIK ANTWERPEN N.V.
Аналитики уточнили, что весь объем поступил в первые три месяца, с апреля поставки бельгийского метионина были прекращены.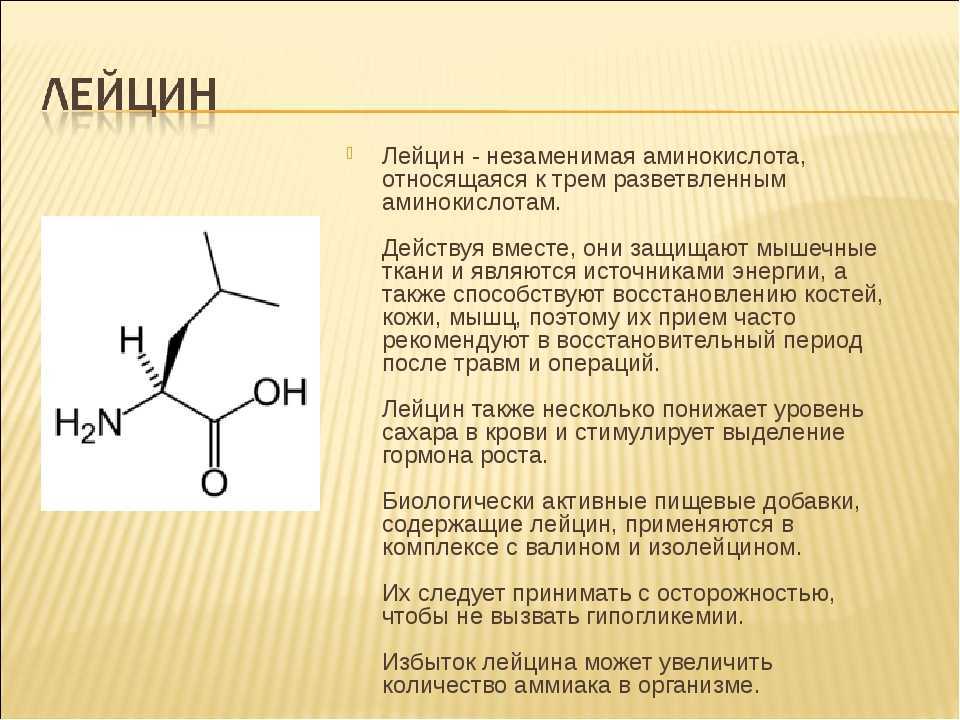
Кроме того, поставки биотина из Бельгии сократились на 62%.
Также снизила объемы импорта кормовых компонентов Франция. Так, отгрузки метионина снизились на 65%, до 287 тонн. Причем в апреле и мае поставки не фиксировались.
Упали объемы импорта французского витамина А1000, объем поставок витамина D3 практически не изменился, а вот поставки французского витамина В9 возросли на 57%, до 12,4 тонн.
Импорт кормовых компонентов из Германии выглядит разнонаправленным. Так, за январь – июнь 2022 года в 2,3 раза возросли поставки немецкого витамина А1000 (всего было ввезено 57 тонн), хотя с марта отгрузки прекратились, обратили внимание аналитики.
При этом витамин Е 50% продолжает поступать из Германии, объемы импорта даже увеличиваются: уже ввезли 505 тонн. Заметно увеличились поставки немецкого витамина В4 (108 тонн), что в 2,5 раза выше объемов годичной давности.
А вот импорт витамина В5 сократился на 46%. Если сравнивать с тем же периодом 2021 года, ввезли только 15 тонн (в апреле поставки отсутствовали). Также сократились поставки немецкого биотина и витамина В2, говорится в обзоре.
Также сократились поставки немецкого биотина и витамина В2, говорится в обзоре.
Метки: аминокислоты, ветеринария, китай, корма. кормовые добавки, кормовые компоненты
Улучшенное производство L-треонина в Escherichia coli с использованием системы каркасов ДНК
1.
Икеда М.
2003.
Процессы получения аминокислот. Доп. Биохим. англ. Биотехнолог.
79:1–35 [PubMed] [Google Scholar]
2.
Ридс П.Дж.
2000.
Незаменимые и незаменимые аминокислоты для человека. Дж. Нутр.
130:1835S–1840S [PubMed] [Google Scholar]
3.
Гийуэ С., Родал А.А., Ан Г., Лессар П.А., Сински А.Дж.
1999.
Экспрессия катаболической треониндегидратазы Escherichia coli в Corynebacterium glutamicum и ее влияние на продукцию изолейцина. заявл. Окружающая среда. микробиол.
65:3100–3107 [бесплатная статья PMC] [PubMed] [Google Scholar]
4.
Guilluet S, Rodal AA, An GH, Gorret N, Lessard PA, Sinskey AJ.
2001.
Метаболическое перенаправление потока углерода в сторону изолейцина за счет экспрессии катаболической треониндегидратазы в продуцирующей треонин Corynebacterium glutamicum.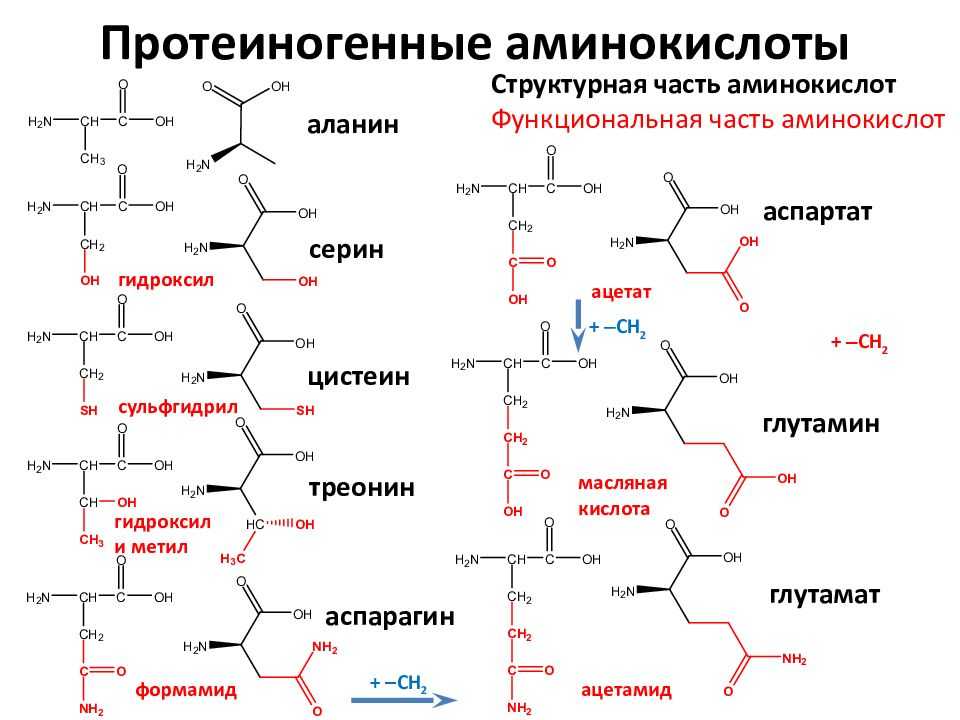 заявл. микробиол. Биотехнолог.
заявл. микробиол. Биотехнолог.
57:667–673 [PubMed] [Google Scholar]
5.
Икеда М., Кацумата Р.
1992.
Метаболическая инженерия для производства тирозина или фенилаланина в штамме Corynebacterium glutamicum, продуцирующем триптофан. заявл. Окружающая среда. микробиол.
58:781–785 [бесплатная статья PMC] [PubMed] [Google Scholar]
6.
Икеда М., Наканиши К., Кино К., Кацумата Р.
1994.
Ферментативная продукция триптофана стабильным рекомбинантным штаммом Corynebacterium glutamicum с модифицированным серин-биосинтетическим путем. Бионауч. Биотехнолог. Биохим.
58:674–678 [PubMed] [Google Scholar]
7.
Икеда М., Одзаки А., Кацумата Р.
1993.
Производство фенилаланина метаболически сконструированными Corynebacterium glutamicum с геном pheA Escherichia coli. заявл. микробиол. Биотехнолог.
39:318–323 [PubMed] [Google Scholar]
8.
Lee KH, Park JH, Kim TY, Kim HU, Lee SY.
2007.
Системная метаболическая инженерия Escherichia coli для продукции L-треонина. Мол. Сист. биол.
3:149. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
9.
Ли С.И., Пак Дж.Х.
2010.
Интеграция системной биологии с инженерией биопроцессов: производство l-треонина системной метаболической инженерией Escherichia coli. Доп. Биохим. англ. Биотехнолог.
120:1–19 [PubMed] [Google Scholar]
10.
Пак Дж. Х., Чан Й. С., Ли Дж. В., Ли СИ.
2011.
Escherichia coli W в качестве нового штамма платформы для усиленного производства l-валина с помощью системной метаболической инженерии. Биотехнолог. биоинж.
108:1140–1147 [PubMed] [Google Scholar]
11.
Пак Дж.Х., Ли С.И.
2010.
Метаболические пути и ферментативное производство аминокислот семейства L-аспартатов. Биотехнолог. Дж.
5:560–577 [PubMed] [Google Scholar]
12.
Тиноко И.
2002.
Физическая химия: принципы и приложения в биологических науках, 4-е изд.
Prentice Hall, Upper Saddle River, NJ [Google Scholar]
13.
Роу А.Дж., О’Бирн С., Маклагган Д., Бут И.Р.
2002.
Ингибирование роста кишечной палочки уксусной кислотой: проблема биосинтеза метионина и токсичность гомоцистеина.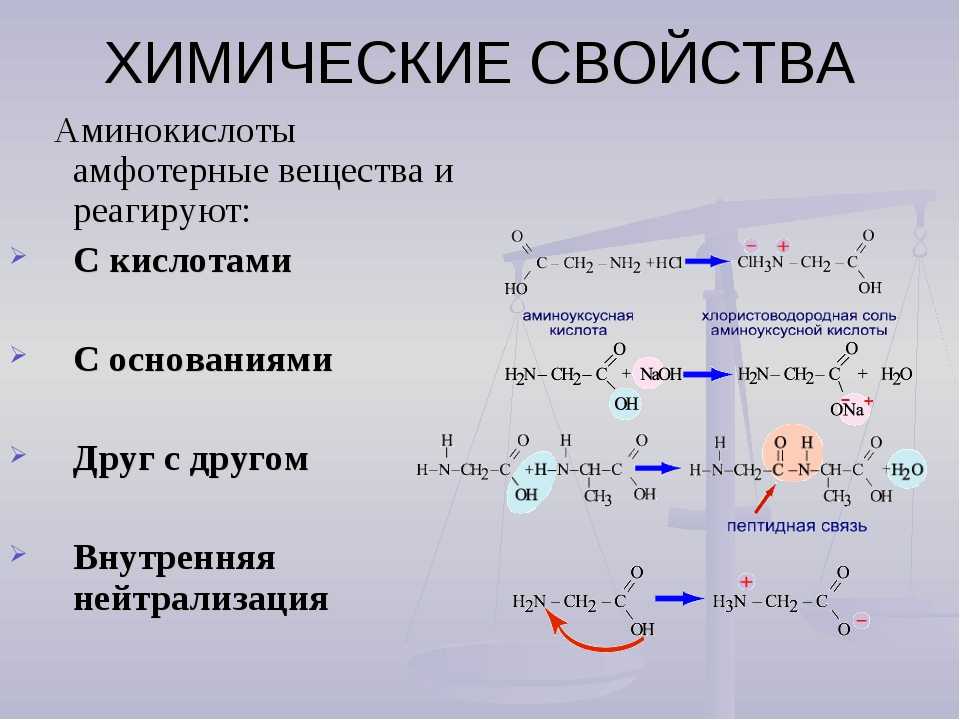 микробиология
микробиология
148:2215–2222 [PubMed] [Google Scholar]
14.
Конрадо Р.Дж., Варнер Д.Д., ДеЛиза М.П.
2008.
Разработка пространственной организации метаболических ферментов: имитация синергии природы. Курс. мнение Биотехнолог.
19:492–499 [PubMed] [Google Scholar]
15.
Башор С.Дж., Хорвиц А.А., Пейсайович С.Г., Лим В.А.
2010.
Перепрошивка клеток: синтетическая биология как инструмент для изучения принципов организации живых систем. Анну. Преподобный Биофиз.
39:515–537 [бесплатная статья PMC] [PubMed] [Google Scholar]
16.
Блузар Дж. К., Коутиньо П. М., Фиробе Х. П., Хенриссат Б., Линьон С., Тардиф К., Пейдж С., де Филип П.
2010.
Модуляция состава целлюлозы у Clostridium cellulolyticum: адаптация к полисахаридной среде, выявленная протеомным анализом и анализом углеводно-активных ферментов. протеомика
10:541–554 [PubMed] [Google Scholar]
17.
Бомбл Й.Дж., Бекхэм Г.Т., Мэтьюз Дж.Ф., Нимлос М.Р., Химмель М.Э., Кроули М.Ф.
2011.
Моделирование самосборки целлюлозосомного ферментного комплекса.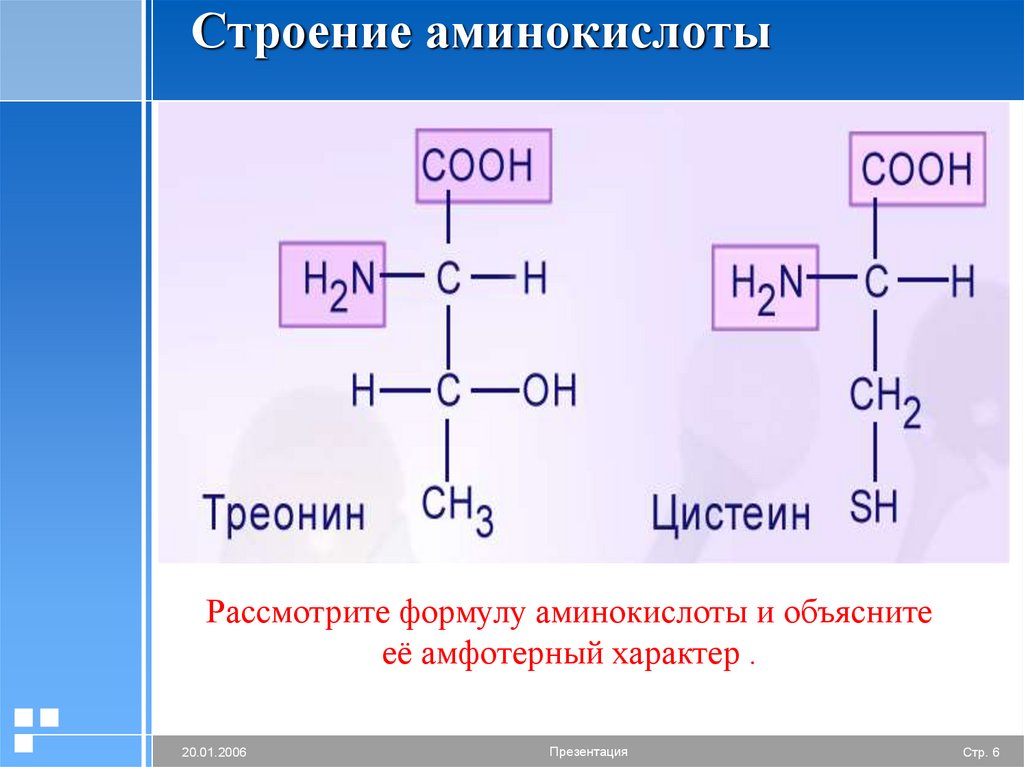 Дж. Биол. хим.
Дж. Биол. хим.
286:5614–5623 [бесплатная статья PMC] [PubMed] [Google Scholar]
18.
Дюбер Дж.Э., Ву Г.К., Мальмирчегини Г.Р., Мун Т.С., Петцольд С.Дж., Уллал А.В., Пратер К.Л., Кислинг Д.Д.
2009.
Синтетические белковые каркасы обеспечивают модульный контроль над метаболическим потоком. Нац. Биотехнолог.
27:753–759 [PubMed] [Google Scholar]
19.
Хороший MC, Zalatan JG, Lim WA.
2011.
Каркасные белки: узлы для управления потоком клеточной информации. Наука
332:680–686 [бесплатная статья PMC] [PubMed] [Google Scholar]
20.
Лим В.А.
2010.
Разработка индивидуальных цепей сигнализации сотовой связи. Нац. Преподобный Мол. Клеточная биол.
11:393–403 [бесплатная статья PMC] [PubMed] [Google Scholar]
21.
Мицузава С., Кагава Х., Ли И., Чан С.Л., Паавола К.Д., Трент Д.Д.
2009.
Розеттазим: синтетическая целлюлоза. Дж. Биотехнология.
143:139–144 [PubMed] [Google Scholar]
22.
Нордон Р.Э., Крейг С.Дж., Фунг Ф.К.
2009.
Молекулярная инженерия целлюлосомного комплекса для применения в аффинити и биоэнергетике.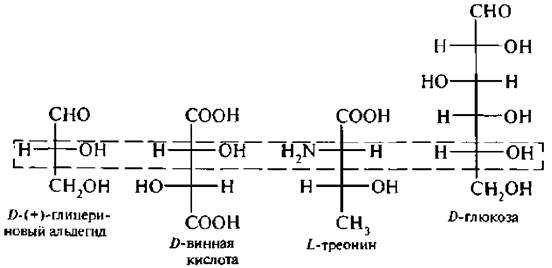 Биотехнолог. лат.
Биотехнолог. лат.
31:465–476 [PubMed] [Google Scholar]
23.
Пейсайович С.Г., Гарбарино Дж.Е., Вэй П., Лим В.А.
2010.
Быстрая диверсификация фенотипов передачи сигналов клеток за счет рекомбинации модульных доменов. Наука
328:368–372 [бесплатная статья PMC] [PubMed] [Google Scholar]
24.
Янив О., Шимон Л.Дж., Байер Э.А., Ламед Р., Фролов Ф.
2011.
Модуль связывания углеводов семейства 3b, связанный с скаффолдином, из целлюлосомы Bacteroides cellulosolvens: структурное разнообразие и значение кальция для связывания углеводов. Акта Кристаллогр. Д биол. Кристаллогр.
67: 506–515 [PubMed] [Google Scholar]
25.
Зик А., Лукач М., Лим В.А., Ременьи А.
2009.
Каркасы: интерактивные платформы для сотовых сигнальных цепей. Тенденции клеточной биологии.
19:364–374 [бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Делебек С.Дж., Линднер А.Б., Сильвер П.А., Алдай Ф.А.
2011.
Организация внутриклеточных реакций с помощью рационально сконструированных ансамблей РНК. Наука
333:470–474 [PubMed] [Google Scholar]
27.
Конрадо Р.Дж., Ву Г.К., Бук Дж.Т., Сюй Х., Чен С.Ю., Лебар Т., Турнсек Дж., Томшич Н., Авбель М., Габер Р., Копривняк Т., Мори Дж., Главник В., Вовк И., Бенчина М., Ходник В., Андерлух Г. , Дьюбер Дж. Э., Джерала Р., Делиса М.П.
2012.
Направляемая ДНК сборка путей биосинтеза способствует повышению каталитической эффективности. Нуклеиновые Кислоты Res.
40:1879–1889 [бесплатная статья PMC] [PubMed] [Google Scholar]
28.
Блаттнер Ф.Р., Планкетт Г., III, Блох К.А., Перна Н.Т., Бурланд В., Райли М., Колладо-Видес Дж., Гласнер Д.Д., Роде К.К., Мэйхью Г.Ф., Грегор Дж., Дэвис Н.В., Киркпатрик Х.А., Геден М.А., Роуз Д.Дж., Мау Б, Шао Ю.
1997.
Полная последовательность генома Escherichia coli K-12. Наука
277:1453–1462 [PubMed] [Google Scholar]
29.
Шио И., Накамори С., Сано К.
Может
1971.
Ферментативное производство L-треонина. Патент США 3 580 810
30.
Lee JH, Sung BH, Kim MS, Blattner FR, Yoon BH, Kim JH, Kim SC.
2009 г..
Метаболическая инженерия штамма Escherichia coli с уменьшенным геномом для производства L-треонина. микроб. Сотовый факт.
микроб. Сотовый факт.
8:2
doi:10.1186/1475-2859-8-2 [бесплатная статья PMC] [PubMed] [Google Scholar]
31.
Lee JY, Sung BH, Yu BJ, Lee JH, Lee SH, Kim MS, Koob MD, Kim SC.
2008.
Фенотипическая инженерия путем перепрограммирования транскрипции генов с использованием новых искусственных факторов транскрипции в Escherichia coli. Нуклеиновые Кислоты Res.
36:е102
doi:10.1093/nar/gkn449 [бесплатная статья PMC] [PubMed] [Google Scholar]
32.
Щесюль М., Вамплер Д.Э.
1976 год.
Регуляция метаболической системы in vitro: синтез треонина из аспарагиновой кислоты. Биохимия
15:2236–2244 [PubMed] [Google Scholar]
33.
Chassagnole C, Rais B, Quentin E, Fell DA, Mazat JP.
2001.
Комплексное исследование кинетики ферментов треонинового пути в Escherichia coli. Биохим. Дж.
356:415–423 [бесплатная статья PMC] [PubMed] [Google Scholar]
34.
Вамплер DE, Вестхед EW.
1968 год.
Две аспартокиназы из Escherichia coli. Характер торможения и молекулярных изменений, сопровождающих обратимую инактивацию.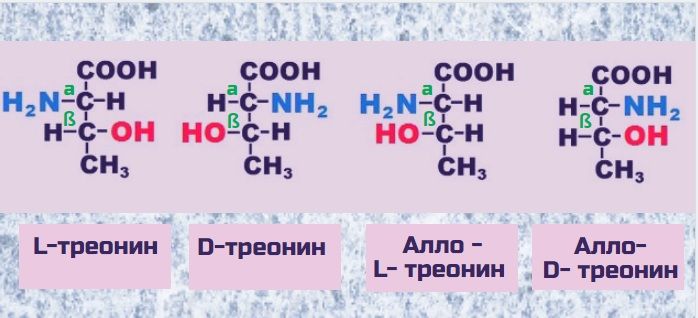 Биохимия
Биохимия
7:1661–1671 [PubMed] [Google Scholar]
35.
Чжо А., Маунг Великобритания, Тое Т.
1985.
Определение неорганического фосфата с молибдатом и Тритоном Х-100 без восстановления. Анальный. Биохим.
145:230–234 [PubMed] [Google Scholar]
36.
Джозеф М.Х., Марсден, Калифорния.
1986 год.
Аминокислоты и малые пептиды, стр. 13–28
В
Лим СК. (ред.), ВЭЖХ малых молекул, практический подход.
IRL Press, Оксфорд, Великобритания [Google Scholar]
37.
Bae KH, Kwon YD, Shin HC, Hwang MS, Ryu EH, Park KS, Yang HY, Lee DK, Lee Y, Park J, Kwon HS, Kim HW, Yeh BI, Lee HW, Sohn SH, Yoon J, Seol W , Ким Дж.С.
2003.
Цинковые пальцы человека как строительные блоки при создании искусственных факторов транскрипции. Нац. Биотехнолог.
21:275–280 [PubMed] [Google Scholar]
38.
Пак К.С., Ли Д.К., Ли Х., Ли И., Чан И.С., Ким Ю.Х., Ян ХИ, Ли Си, Соль В., Ким Дж.С.
2003.
Фенотипическое изменение эукариотических клеток с использованием рандомизированных библиотек искусственных факторов транскрипции.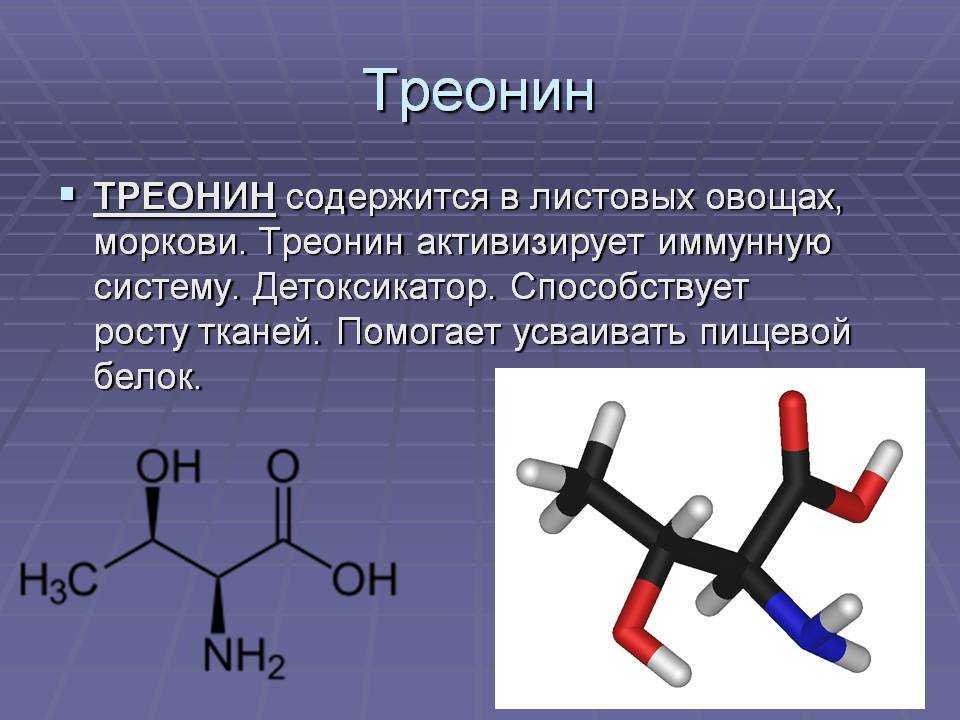 Нац. Биотехнолог.
Нац. Биотехнолог.
21:1208–1214 [PubMed] [Google Scholar]
39.
Далл’Аква В., Саймон А.Л., Малкеррин М.Г., Картер П.
1998.
Вклад остатков интерфейса домена в стабильность гомодимеров домена Ch4 антитела. Биохимия
37:9266–9273 [PubMed] [Google Scholar]
40.
Нейдхардт ФК, Кертисс Р.
1996.
Escherichia coli и Salmonella: клеточная и молекулярная биология, 2-е изд.
ASM Press, Вашингтон, округ Колумбия [Google Scholar]
41.
Shames SL, Ash DE, Wedler FC, Villafranca JJ.
1984.
Взаимодействие аспартата и антиметаболитов аспартата с ферментами пути биосинтеза треонина кишечной палочки. Дж. Биол. хим.
259:15331–15339 [PubMed] [Google Scholar]
42.
Шамес С.Л., Ведлер ФК.
1984.
Гомосеринкиназа Escherichia coli: кинетический механизм и ингибирование полуальдегидом L-аспартата. Арка Биохим. Биофиз.
235:359–370 [PubMed] [Google Scholar]
43.
Ведлер ФК, Лей Б.В.
1993.
Кинетические и регуляторные механизмы гомосериндегидрогеназы-I (Escherichia coli). Кинетика равновесного изотопного обмена.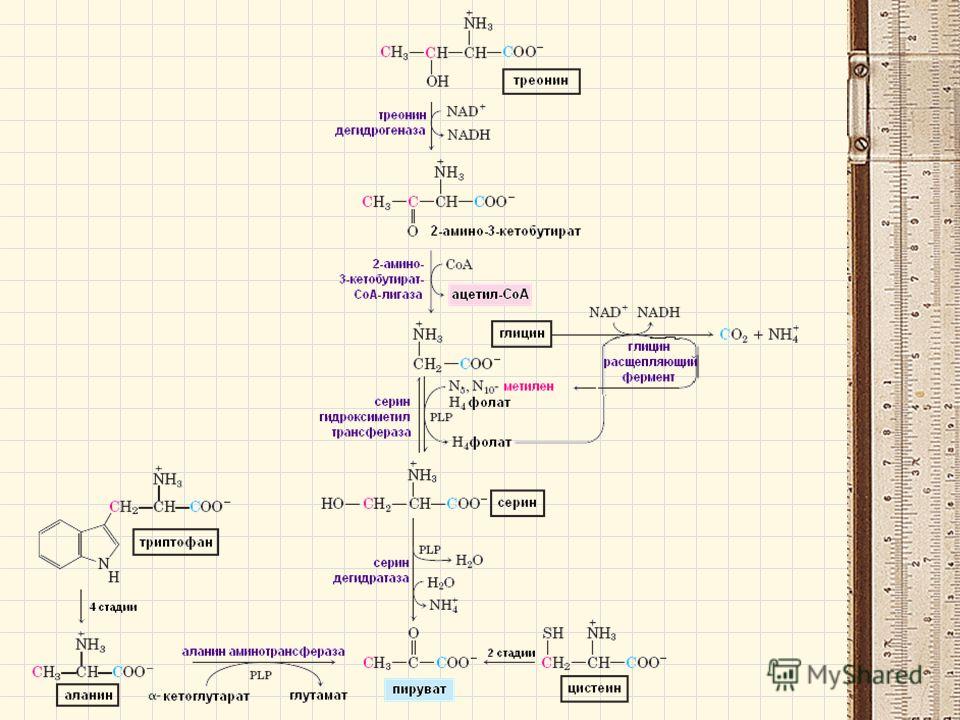 Дж. Биол. хим.
Дж. Биол. хим.
268:4880–4888 [PubMed] [Google Scholar]
44.
Котре А.М., Салливан С.Дж., Саважо М.А.
1973.
Метаболическая регуляция гомосерином в Escherichia coli B-r. Дж. Бактериол.
116:663–672 [бесплатная статья PMC] [PubMed] [Google Scholar]
45.
Исида М., Кавасима Х., Сато К., Хасигучи К., Ито Х., Эней Х., Накамори С.
1994.
Факторы, улучшающие продукцию L-треонина рекомбинантным штаммом Brevibacterium lactofermentum, амплифицированным тремя генами биосинтеза L-треонина. Бионауч. Биотехнолог. Биохим.
58:768–770 [PubMed] [Google Scholar]
46.
Исида М., Сато К., Хасигучи К., Ито Х., Эней Х., Накамори С.
1993.
Высокоферментативная продукция L-треонина из ацетата стабилизированным штаммом Brevibacterium flavum, трансформированным рекомбинантной плазмидой, несущей оперон Escherichia coli thr. Бионауч. Биотехнолог. Биохим.
57:1755–1756 [PubMed] [Google Scholar]
47.
Круз Д., Крамер Р., Эггелинг Л., Рипинг М., Пфефферле В., Чиу Дж. Х., Чанг Ю. Дж., Младший, Сайер М. Х., Бурковски А.
Х., Бурковски А.
2002.
Влияние экспортеров треонина на продукцию треонина в Escherichia coli. заявл. микробиол. Биотехнолог.
59:205–210 [PubMed] [Google Scholar]
48.
Пак Дж.Х., Ли С.И.
2010.
Ферментативное производство аминокислот с разветвленной цепью: акцент на метаболической инженерии. заявл. микробиол. Биотехнолог.
85:491–506 [PubMed] [Google Scholar]
49.
Пак Дж.Х., Ли С.И.
2008.
К системной метаболической инженерии микроорганизмов для производства аминокислот. Курс. мнение Биотехнолог.
19:454–460 [PubMed] [Google Scholar]
50.
Hong SH, Kim JS, Lee SY, In YH, Choi SS, Rih JK, Kim CH, Jeong H, Hur CG, Kim JJ.
2004.
Последовательность генома капнофильной бактерии рубца Mannheimia succiniciproducens. Нац. Биотехнолог.
22:1275–1281 [PubMed] [Google Scholar]
51.
Бхаттачарья Р.П., Ременьи А., Йех Б.Дж., Лим В.А.
2006.
Домены, мотивы и каркасы: роль модульных взаимодействий в эволюции и проводке клеточных сигнальных цепей. Анну. Преподобный Биохим.
75:655–680 [PubMed] [Google Scholar]
52.
Дюбер Дж. Э., Йе Б. Дж., Чак К., Лим В. А.
2003.
Перепрограммирование управления аллостерическим сигнальным переключателем посредством модульной рекомбинации. Наука
301:1904–1908 [PubMed] [Google Scholar]
53.
Феррелл Дж. Э., младший, Симприх К.А.
2003.
Вынужденная близость в функции известного эшафота. Мол. Клетка
11:289–291 [PubMed] [Google Scholar]
54.
Фонтес CM, Гилберт HJ.
2010.
Целлюлосомы: высокоэффективные наномашины, предназначенные для разрушения сложных углеводов растительной клеточной стенки. Анну. Преподобный Биохим.
79:655–681 [PubMed] [Google Scholar]
55.
Гилберт ХДж.
2007.
Целлюлосомы: микробные наномашины, демонстрирующие пластичность четвертичной структуры. Мол. микробиол.
63:1568–1576 [PubMed] [Google Scholar]
56.
Гулдер Т.А., Фриман М.Ф., Пил Дж.
1
Маршировать
2011.
Каталитическое разнообразие мультимодульных поликетидсинтаз: биосинтез натуральных продуктов вне правил сборки учебников. Вершина. Курс. хим. [Epub перед печатью.] doi:10.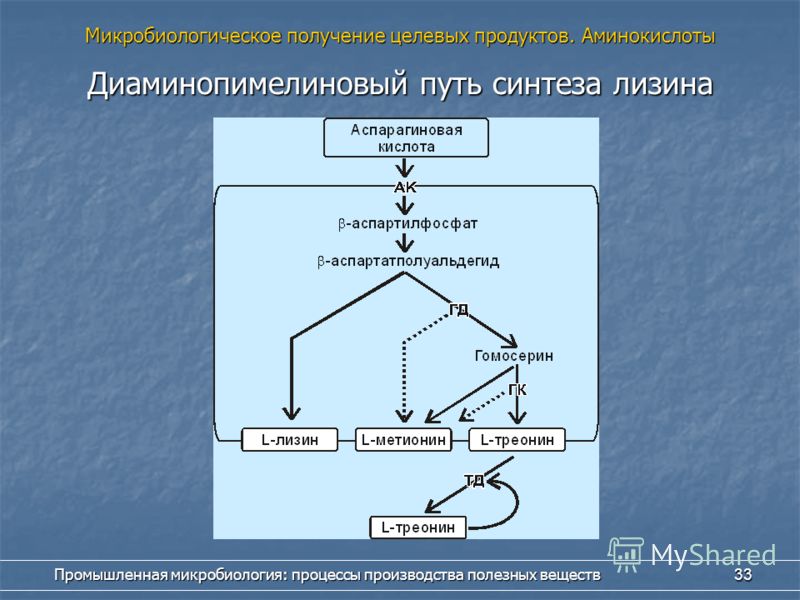 1007/128_2010_113 [PubMed] [Google Scholar]
1007/128_2010_113 [PubMed] [Google Scholar]
57.
Кван Д.Х., Шульц Ф.
2011.
Стереохимия сложного биосинтеза поликетидов модульными поликетидсинтазами. Молекулы
16:6092–6115 [бесплатная статья PMC] [PubMed] [Google Scholar]
58.
Лим В.А.
2002.
Модульная логика сигнальных белков: построение аллостерических переключателей из простых связывающих доменов. Курс. мнение Структура биол.
12:61–68 [PubMed] [Google Scholar]
59.
Майер Т., Лейбундгут М., Берингер Д., Бан Н.
2010.
Структура и функция эукариотических синтаз жирных кислот. Q. Преподобный Биофиз.
43:373–422 [PubMed] [Google Scholar]
60.
Пер А., Смит С.П., Байер Э.А., Ламед Р., Боровок И.
2009.
Нецеллюлосомные когезиновые и докериноподобные модули в трех областях жизни. ФЭМС микробиол. лат.
291:1–16 [бесплатная статья PMC] [PubMed] [Google Scholar]
61.
Бхакта М.С., Сигал Д.Дж.
2010.
Генерация белков цинковых пальцев методом модульной сборки. Методы Мол. биол.
649:3–30 [бесплатная статья PMC] [PubMed] [Google Scholar]
62.
Иманиши М., Накамура А., Морисаки Т., Футаки С.
2009.
Положительная и отрицательная кооперативность модульно собранных цинковых пальцев. Биохим. Биофиз. Рез. коммун.
387:440–443 [PubMed] [Google Scholar]
63.
Янц Д., Берг Дж.М.
2010.
Исследование ДНК-связывающей аффинности и специфичности сконструированных белков цинковых пальцев. Биофиз. Дж.
98:852–860 [бесплатная статья PMC] [PubMed] [Google Scholar]
64.
Тезе Дж., Клейдман Л., Сент-Жиронс И.
1974.
Гомосеринкиназа из Escherichia coli K-12: свойства, ингибирование l-треонином и регуляция биосинтеза. Дж. Бактериол.
118:577–581 [бесплатная статья PMC] [PubMed] [Google Scholar]
65.
Вудгейт Дж., Палфри Д., Нагель Д.А., Хайн А.В., Слейтер Н.К.
2002.
Белково-опосредованное выделение плазмидной ДНК с помощью аффинного линкера цинковый палец-глутатион-S-трансфераза. Биотехнолог. биоинж.
79:450–456 [PubMed] [Google Scholar]
66.
Дежарле Дж. Р., Берг Дж. М.
1993.
Использование консенсусной последовательности цинковых пальцев и правил специфичности для разработки специфических ДНК-связывающих белков. проц. Натл. акад. науч. США.
проц. Натл. акад. науч. США.
90:2256–2260 [бесплатная статья PMC] [PubMed] [Google Scholar]
67.
Медер С.И., Хинк М.А., Кинхабвала А., Майр Р., Бастианс П.И., Кноп М.
2007.
Пространственная регуляция активности киназы Fus3 MAP посредством механизма реакции-диффузии в передаче сигналов феромонов дрожжей. Нац. Клеточная биол.
9:1319–1326 [PubMed] [Google Scholar]
68.
Слотер Б.Д., Шварц Дж.В., Ли Р.
2007.
Картирование динамических белковых взаимодействий в передаче сигналов киназы MAP с использованием спектроскопии флуктуаций флуоресценции живых клеток и визуализации. проц. Натл. акад. науч. США.
104:20320–20325 [бесплатная статья PMC] [PubMed] [Google Scholar]
69.
Фишер Х, Поликарпов И, Крайевич АФ.
2004.
Средняя плотность белка является функцией, зависящей от молекулярной массы. Белковая наука.
13:2825–2828 [бесплатная статья PMC] [PubMed] [Google Scholar]
Преимущества, применение, продукты питания, добавки и побочные эффекты треонина
Факт проверен
Этот контент Dr.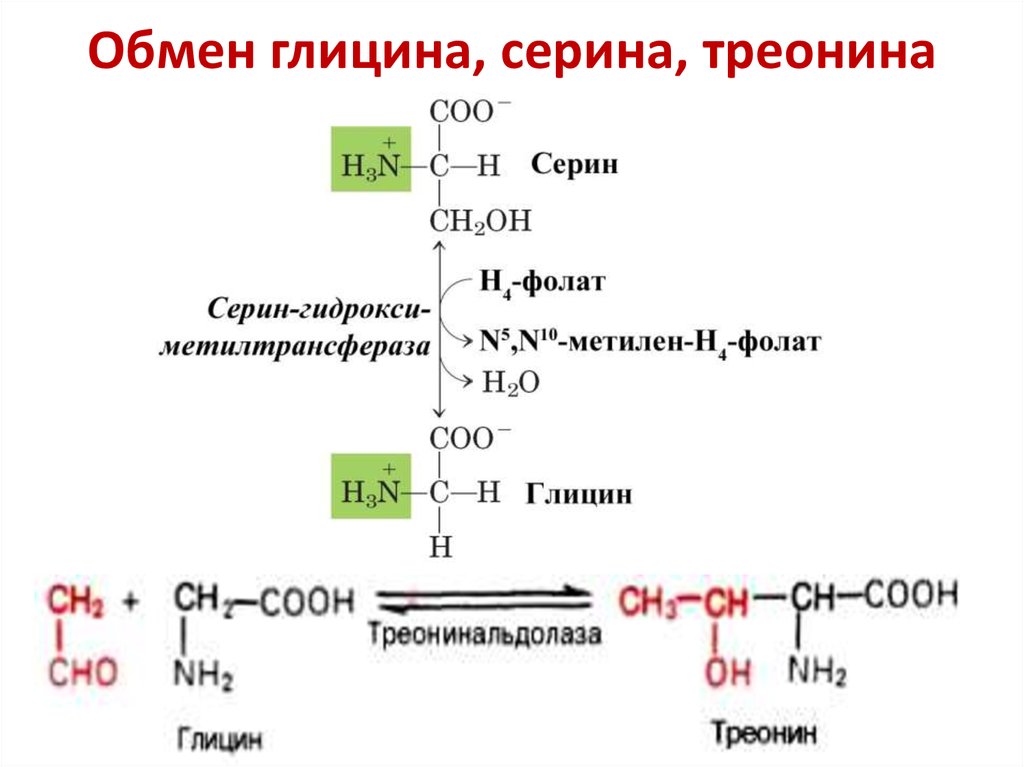 Axe прошел медицинскую проверку или проверку фактов, чтобы гарантировать достоверность информации.
Axe прошел медицинскую проверку или проверку фактов, чтобы гарантировать достоверность информации.
Следуя строгим редакционным правилам поиска источников, мы ссылаемся только на академические исследовательские институты, авторитетные сайты СМИ и, если доступны исследования, на исследования, прошедшие рецензирование с медицинской точки зрения. Обратите внимание, что числа в скобках (1, 2 и т. д.) являются интерактивными ссылками на эти исследования.
Информация в наших статьях НЕ предназначена для замены личных отношений с квалифицированным медицинским работником и не предназначена в качестве медицинской консультации.
Эта статья основана на научных данных, написанных экспертами и проверенных нашей квалифицированной редакцией. Обратите внимание, что числа в скобках (1, 2 и т. д.) являются интерактивными ссылками на исследования, прошедшие рецензирование с медицинской точки зрения.
В нашу команду входят лицензированные диетологи и диетологи, сертифицированные специалисты по санитарному просвещению, а также сертифицированные специалисты по силовой и физической подготовке, персональные тренеры и специалисты по корректирующим упражнениям. Наша команда стремится быть не только тщательной в своих исследованиях, но и объективной и непредвзятой.
Наша команда стремится быть не только тщательной в своих исследованиях, но и объективной и непредвзятой.
Информация в наших статьях НЕ предназначена для замены личных отношений с квалифицированным медицинским работником и не предназначена в качестве медицинской консультации.
Кристин Руджери, CHHC
19 августа 2019 г.
Скорее всего, вы мало слышали о треонине, но эта аминокислота участвует в целом ряде биологических процессов. Он наиболее известен своей ролью в формировании основы соединительных тканей, таких как коллаген и эластин.
Он также помогает регулировать пищеварение, настроение и рост мышц.
Незаменимые аминокислоты, такие как треонин, являются строительными блоками белков. Они играют жизненно важную роль в структуре наших костей, мышц и кожи.
Когда мы не едим достаточное количество продуктов с высоким содержанием этих важных соединений, мы можем испытывать симптомы дефицита, такие как изменения настроения, раздражительность, спутанность сознания и проблемы с пищеварением.
Это еще одна причина, по которой так важно придерживаться хорошо сбалансированной диеты, включающей ряд продуктов с высоким содержанием белка, чтобы вы получали достаточное количество незаменимых аминокислот.
Что такое треонин?
Треонин — незаменимая аминокислота, играющая важную роль в регулировании белкового баланса в организме. Поскольку он считается «незаменимой аминокислотой», это означает, что организм не синтезирует аминокислоту, поэтому нам нужно есть продукты с высоким содержанием треонина, чтобы получить его.
Аббревиатура треонина — Thr, а его однобуквенный код — T. Правильное произношение треонина — «three-uh-need».
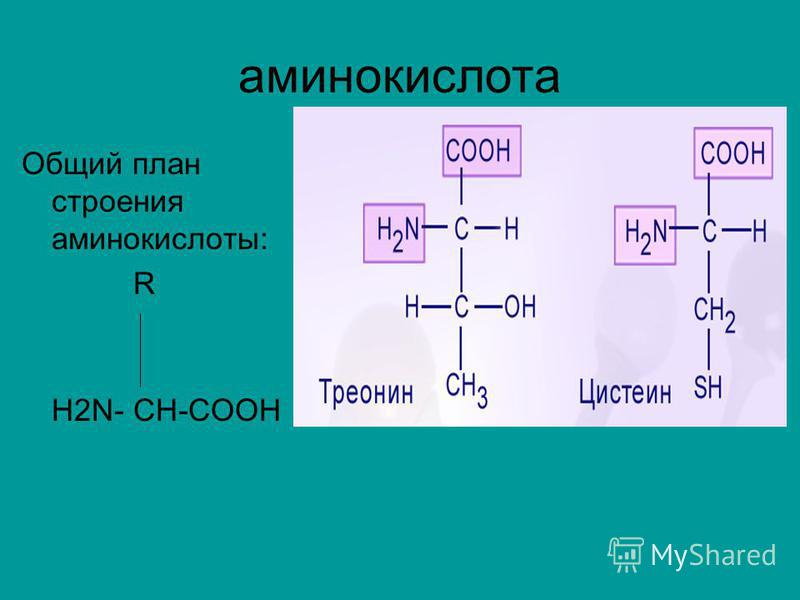
Формула треонина C4H9NO3, содержит аминогруппу, карбоксильную группу и боковую цепь, содержащую гидроксильную группу. Это делает структуру треонина полярной незаряженной аминокислотой.
Аминокислота
Thr встречается в природе в L-форме, L-треонине. Это сопряженное основание L-треониния и сопряженная кислота L-треонината.
Вот несколько распространенных вопросов о структуре аминокислоты треонина:
- Сколько стереоизомеров имеет треонин? Thr имеет четыре возможных стереоизомера: (2S,3R), (2R,3S), (2S,3S) и (2R,3R).
- Является ли треонин положительно заряженным? Аминокислота Т считается обладающей полярными свойствами.
- Является ли треонин кислотным или основным? Thr считается полярным, тогда как аминокислоты лизин и аргинин считаются основными и заряженными, а аспартат и глутамат – кислыми и отрицательно заряженными.
- Что такое кодон треонина? Возможные кодоны треонина включают ACA, ACC, ACG и ACT.
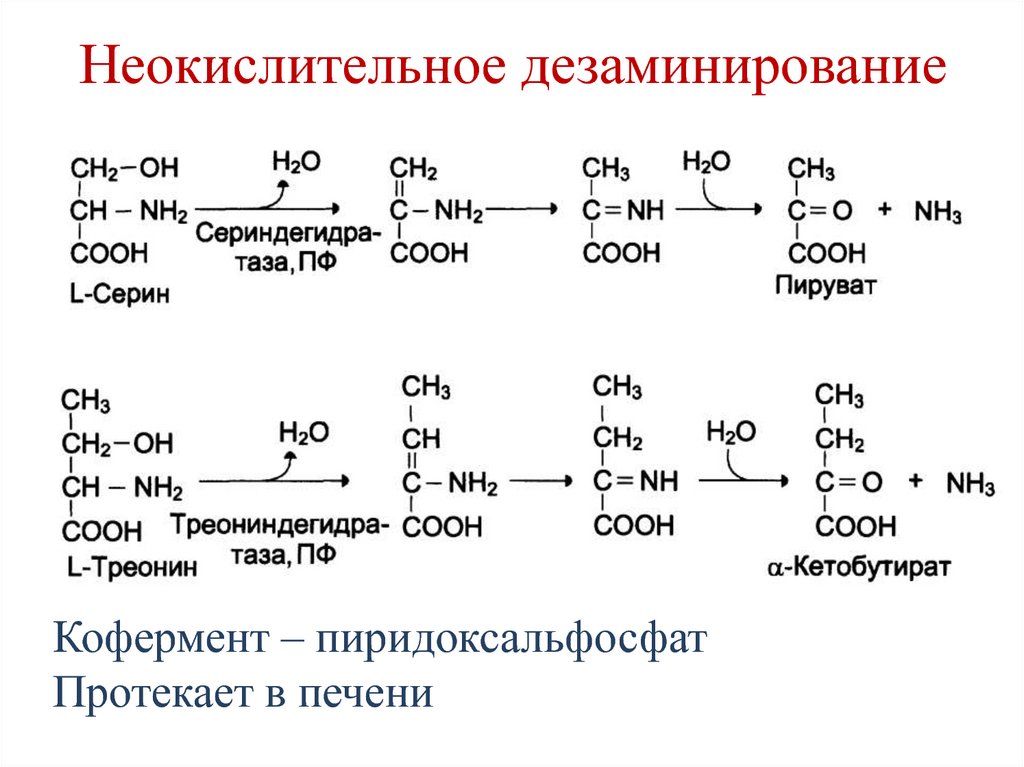
Аминокислота Т является предшественником серина и глицина, двух других аминокислот, которые необходимы для правильного функционирования организма.
Глицин является условно незаменимой аминокислотой, что означает, что он вырабатывается в небольших количествах человеческим организмом. Он также доступен в продуктах питания, и многие люди могут извлечь пользу из своего рациона.
Он также доступен в продуктах питания, и многие люди могут извлечь пользу из своего рациона.
Это особенно верно, если у человека есть заболевание, которое ограничивает синтез глицина.
Преимущества
1. Поддерживает здоровье пищеварительной системы
Треонин защищает пищеварительный тракт, образуя слой слизистого геля, который покрывает его и служит барьером для повреждения пищеварительных ферментов. Эта важная аминокислота также поддерживает здоровую функцию кишечника, способствуя защитному действию слизистого барьера кишечника.
Согласно исследованию, опубликованному в Frontiers in Bioscience , большая часть диетического треонина используется для синтеза белка слизистой кишечника. По этой причине потребление продуктов Thr может помочь улучшить здоровье кишечника при физиологических и патологических состояниях как у людей, так и у животных.
2. Укрепляет иммунную систему
Нам нужно достаточно Thr, чтобы поддерживать нормальную работу иммунной системы. Вилочковая железа использует незаменимую аминокислоту для производства Т-клеток или Т-лимфоцитов, которые борются с инфекциями внутри организма.
Вилочковая железа использует незаменимую аминокислоту для производства Т-клеток или Т-лимфоцитов, которые борются с инфекциями внутри организма.
Исследование, опубликованное в Cold Spring Harbour Perspectives in Biology , утверждает, что «серин/треонинкиназы контролируют эпигенетические, транскрипционные и метаболические программы, определяющие функцию Т-клеток». Исследователи объясняют, что на базовом уровне серин- и треонинкиназы работают как ряд переключателей, которые запускают антигенные и цитокиновые рецепторы, составляющие иммунную систему.
3. Может улучшить сокращение мышц
Хотя для дальнейшего понимания его роли необходимы дополнительные исследования, есть некоторые свидетельства того, что Thr может улучшать симптомы БАС, также известного как болезнь Лу Герига. Аминокислота Thr повышает уровень глицина в центральной нервной системе.
Глицин используется для лечения спастичности, поэтому L-треонин был оценен на предмет его способности уменьшать спастичность или сокращение мышц у пациентов с БАС.
В обзоре, проведенном в Австралии, исследователи обнаружили, что двойное слепое плацебо-контролируемое исследование перорального приема L-треонина для лечения спастичности позвоночника указывает на умеренный спазмолитический эффект. Однако исследования с участием пациентов с БАС не показывают улучшения при лечении L-thr.
Эти смешанные обзоры предполагают, что использование добавок L-треонина может помочь уменьшить мышечные сокращения, но не может быть эффективным при симптомах БАС.
4. Поддерживает силу мышц и костей
Знаете ли вы, что белки коллагена и эластина нуждаются в треонине для правильного производства? Возможно, вы уже знаете, что коллаген является наиболее распространенным белком в организме, и он содержится в наших мышцах, костях, коже, кровеносных сосудах, сухожилиях и пищеварительной системе.
Поскольку Thr способствует выработке коллагена, он играет жизненно важную роль в здоровье ваших костей и мышц.
Исследование, проведенное Техасским университетом A&M, показало, что глицин из треонина, пролина и гидроксипролина составляет 57 процентов от общего количества аминокислот в коллагене. Аминокислота Thr является предшественником глицина, который также используется во время биосинтеза креатина, обеспечивая мышцы прямым источником топлива для восстановления повреждений.
Аминокислота Thr является предшественником глицина, который также используется во время биосинтеза креатина, обеспечивая мышцы прямым источником топлива для восстановления повреждений.
Треонин также обеспечивает правильную функцию эластина. Эластин – это белок, который содержится в соединительной ткани и позволяет коже, сухожилиям и связкам восстанавливать форму после растяжения или сокращения.
5. Помогает предотвратить ожирение печени
Аминокислота
Thr предотвращает накопление жира в печени. Он делает это, регулируя жировой обмен и облегчая липотропную функцию.
Литропные соединения расщепляют жир во время метаболизма, и без аминокислот треонина, метионина и аспарагиновой кислоты это было бы невозможно. Дефицит треонина может привести к ожирению печени и даже к печеночной недостаточности.
Исследование на животных, опубликованное в Американском журнале физиологии , показало, что диета с дефицитом Thr увеличивает разобщение митохондрий в печени. Это означает, что диеты, в которых отсутствует качественная белковая пища, содержащая незаменимые аминокислоты, могут привести к нарушению работы клеток и накоплению жира в печени.
Это означает, что диеты, в которых отсутствует качественная белковая пища, содержащая незаменимые аминокислоты, могут привести к нарушению работы клеток и накоплению жира в печени.
6. Может облегчить тревогу и легкую депрессию
Исследования показывают, что изменения уровня аминокислот в сыворотке, включая серин и глицин, для производства которых требуется Thr, связаны с большой депрессией. Исследователи из Бельгии обнаружили, что изменения уровней треонина, аспартата, аспарагина и серина могут предсказывать реакцию пациента на лечение антидепрессантами путем изменения уровня аминокислот в организме.
Поскольку Thr является предшественником глицина, который помогает успокоить нервы и поддерживать когнитивное здоровье, его часто используют в качестве добавки для снятия признаков тревоги и депрессии. Глицин также известен своей способностью улучшать сон, умственную деятельность, настроение и память.
7. Ускоряет заживление ран
Треонин необходим для правильного производства коллагена, необходимого для формирования соединительной ткани и заживления ран.
Исследования показывают, что после ожогов или травм у людей наблюдается больший выброс треонина с мочой. Это указывает на то, что аминокислота метаболизируется из тканей организма после травмы.
Увеличение потребления Thr через продукты или добавки с аминокислотами T может помочь ускорить заживление ран, ожогов и других форм травм.
Симптомы и причины дефицита
Дефицит треонина встречается редко, так как большинство людей получают достаточное количество аминокислот с пищей. Однако люди с несбалансированным питанием, веганы и вегетарианцы могут не потреблять достаточное количество треонина, что может привести к снижению уровня аминокислоты.
Дефицит Thr может вызвать следующие симптомы:
- проблемы с пищеварением
- раздражительность или эмоциональное возбуждение
- путаница
- повышенный жир печени
- плохое усвоение питательных веществ
Пищевые продукты и добавки
В чем содержится треонин?
Аминокислота Т встречается в природе в форме L-треонина. Хорошо сбалансированная диета, включающая высококачественные белковые продукты, обеспечит организм достаточным количеством белка для поддержания нормального уровня.
Хорошо сбалансированная диета, включающая высококачественные белковые продукты, обеспечит организм достаточным количеством белка для поддержания нормального уровня.
К продуктам с высоким содержанием треонина относятся:
- Органическое мясо (включая курицу, баранину, говядину и индейку)
- Рыба, выловленная в дикой природе (включая дикого лосося)
- Молочные продукты
- Творог
- Яйца
- Морковь
- Бананы
- Семена кунжута
- Семена тыквы
- Фасоль
- Эдамаме
- Спирулина
- Чечевица
Дефицит Thr встречается редко у людей, придерживающихся хорошо сбалансированной диеты с высоким содержанием белка. Для веганов и вегетарианцев употребление в пищу бобов, семян и гороха поможет поддерживать нормальный уровень.
Порошок и капсулы L-треонина
можно приобрести в Интернете или в большинстве магазинов здоровой пищи. Вы также можете обнаружить, что добавки с эластином содержат L-треонин.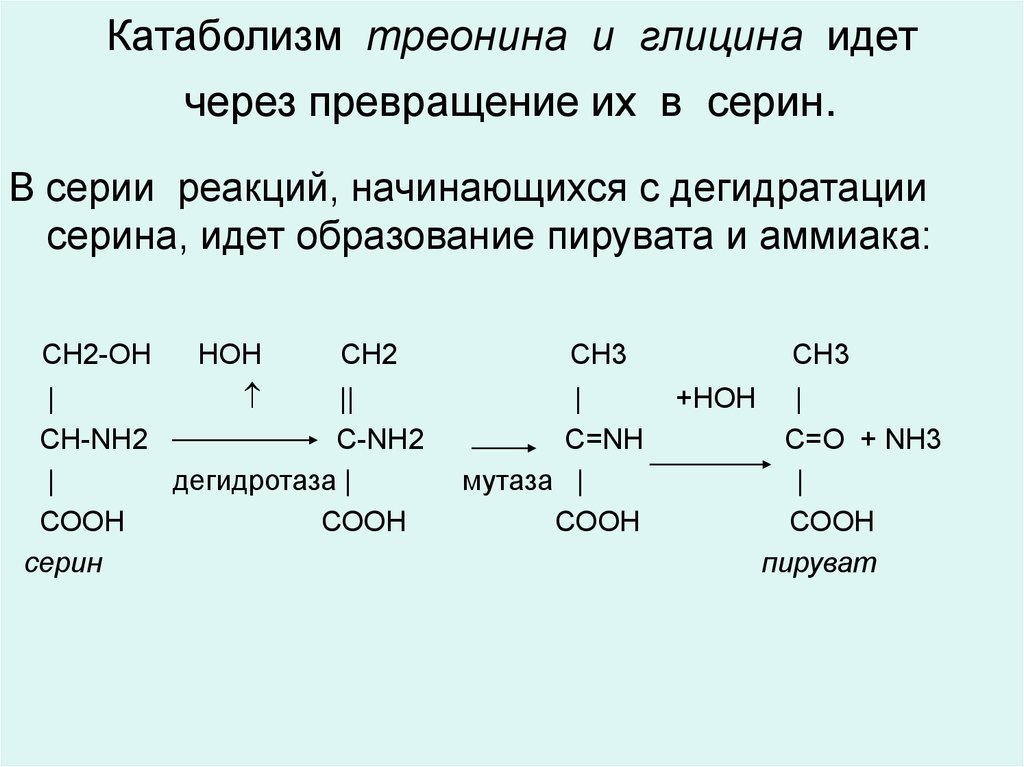
Как принимать и дозировка
Вы, скорее всего, найдете добавки треонина в виде 500-миллиграммовых капсул, которые можно принимать до трех раз в день, в зависимости от ваших потребностей в здоровье и уровня дефицита Т-аминокислот.
Наиболее распространенная доза L-треонина составляет 500–1000 мг в день. Исследования показывают, что дозы до четырех граммов в день в течение 12 месяцев, вероятно, безопасны.
Если вы используете L-треонин для устранения дефицита или улучшения симптомов любого состояния здоровья, делайте это под наблюдением врача или медицинского работника.
Рецепты
Есть так много способов включить Thr в свой рацион. Сосредоточьтесь на том, чтобы получать достаточное количество белка с пищей.
Вы можете сделать это с органическим мясом, дикой рыбой, яйцами, бобами, орехами и семенами. Вот несколько полезных и вкусных рецептов для начала:
- Рецепт курицы с грибами пекорино: это низкоуглеводный, безглютеновый и кето-дружественный рецепт курицы, который также включает грибы, топленое масло, гвоздику и сыр пекорино.

- Рецепт яиц Бенедикт, полезных для сердца: эта полезная версия яиц Бенедикт готовится из противовоспалительных продуктов, таких как авокадо, спаржа и помидоры.
- Чили из индейки с фасолью адзуки Рецепт: это сочетание индейки и фасоли с высоким содержанием этой аминокислоты. В дополнение к белку этот рецепт также богат полезными жирами и железом.
Риски и побочные эффекты
Хотя добавки с треонином в соответствующих количествах обычно считаются безопасными, у некоторых людей могут возникать незначительные побочные эффекты, такие как головная боль, тошнота, расстройство желудка и кожная сыпь.
Недостаточно доказательств, чтобы рекомендовать женщинам, которые беременны или кормят грудью, принимать добавки треонина. Вместо этого лучше всего получать достаточное количество аминокислот из хорошо сбалансированной диеты.
Люди, принимающие антагонисты NMDA, называемые мемантином (Namenda), которые являются типом лекарства от болезни Альцгеймера, должны избегать использования этой добавки.